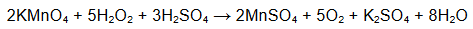Liczba koordynacyjna
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
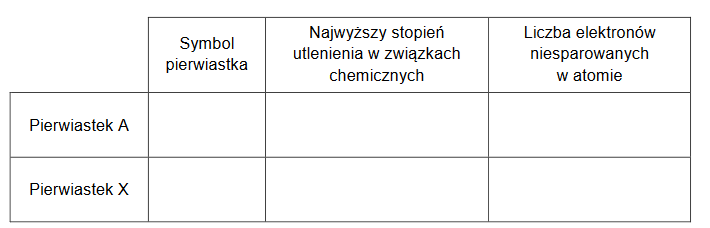
Liczba koordynacyjna to liczba najbliższych atomów lub jonów otaczających dany atom lub jon w sieci krystalicznej kryształu.
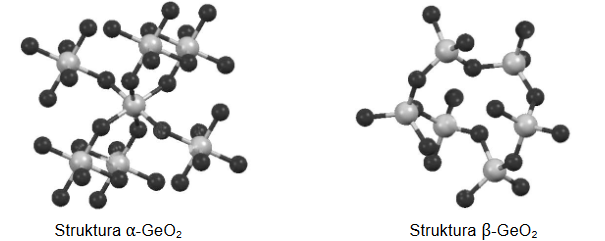
Tlenek germanu(IV) jest krystalicznym ciałem stałym. Istnieje w dwóch odmianach: alfa, α-GeO2, oraz beta, β-GeO2. Fragmenty struktur obu odmian przedstawiono poniżej (atomy Ge – szare, atomy O – czarne).
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W odmianie α-GeO2 liczba koordynacyjna dla atomu germanu wynosi (dwa / cztery / sześć). W strukturze odmiany β-GeO2 dla orbitali walencyjnych atomu germanu zakłada się hybrydyzację (sp2 / sp3).
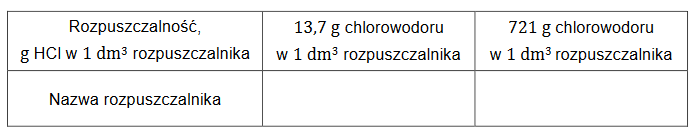
Właściwości kwasu solnego
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
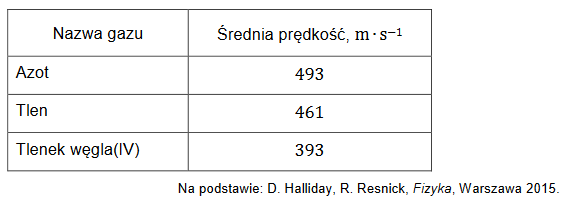
Reakcja kwasu solnego z wodorotlenkiem baru przebiega zgodnie z równaniem:
H3O+ + OH– → 2H2O
Oblicz, ile 𝐜𝐦𝟑 wodnego roztworu wodorotlenku baru o stężeniu molowym równym 𝟎, 𝟎𝟐𝟎 𝐦𝐨𝐥 ∙ 𝐝𝐦−𝟑 należy dodać do 𝟐𝟓 𝐜𝐦𝟑 kwasu solnego o pH = 1,5, aby otrzymany roztwór miał pH równe 3,7. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Reakcje z wodnym roztworem chlorku manganu(II)
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
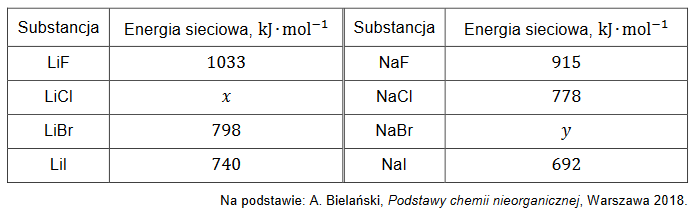
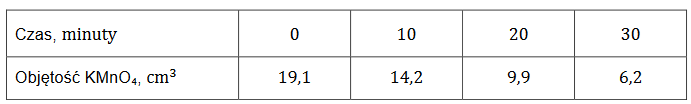
W 150 cm3 wodnego roztworu chlorku manganu(II) o stężeniu molowym 𝑐 = 0,678 mol ∙ dm−3 i gęstości 𝑑 = 1,07 g ∙ cm−3 rozpuszczono 6,00 g hydratu tej soli o wzorze MnCl2 ∙ 4H2O.
Na podstawie: Z. Dobkowska, K.M. Pazdro, Szkolny poradnik chemiczny, Warszawa 2020.
Oblicz, jaki procent masy otrzymanego roztworu stanowi masa chlorku manganu(II). Załóż, że objętość roztworu się nie zmieniła. Przyjmij wartości mas molowych:
MMnCl2 = 126 g ∙ mol–1 oraz
MMnCl2 ∙ 4H2O = 198 g ∙ mol–1.
Reakcje z wodorotlenkiem sodu
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
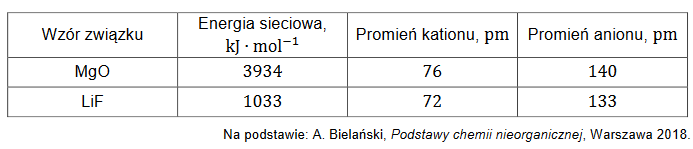
Jony FeO42– mogą powstać podczas reakcji Fe(OH)3 z jonami ClO– w nasyconym roztworze NaOH, zilustrowanej poniższym schematem:
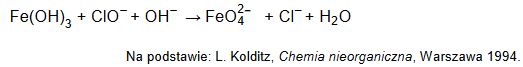
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji utleniania
zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji. Uzupełnij współczynniki stechiometryczne w schemacie.
Równanie reakcji utleniania:
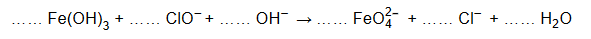
Reakcje z wodorotlenkiem wapnia
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
Do zawiesiny zawierającej 0,5 mol wodorotlenku wapnia dodano wodny roztwór zawierający 1 mol chlorku amonu. Zaobserwowano powstanie klarownego roztworu i gazu o charakterystycznym zapachu.
1. Uzupełnij schemat, tak aby przedstawiał w formie jonowej równanie reakcji zachodzącej podczas roztwarzania wodorotlenku wapnia w wodnym roztworze chlorku amonu.

2. Spośród poniżych metod rozdzielania mieszanin wybierz i zaznacz tę, którą można zastosować do wyodrębnienia z mieszaniny poreakcyjnej związku wapnia.
sączenie
odparowanie
ekstrakcja
3. Spośród poniżych związków chemicznych wybierz i zaznacz wszystkie te, których roztwory dodane do zawiesiny wodorotlenku wapnia spowodują powstanie klarownych roztworów.
HCl
KOH
KCl
NH4NO3
Stężeniowa stała równowagi reakcji
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
Stężeniowa stała równowagi reakcji zilustrowanej poniższym równaniem:
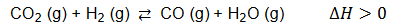
w temperaturze T wynosi 1,0.
1. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

2. W reaktorze o pojemności 1,0 dm3 zmieszano w temperaturze
T tlenek węgla(IV) i wodór. Sumaryczna liczba moli tych reagentów była równa 10.
Oblicz początkową liczbę moli tlenku węgla(IV) i początkową liczbę moli wodoru w mieszaninie, jeżeli wiadomo, że do momentu ustalenia się stanu równowagi w temperaturze T przereagowało 60 % wodoru.
Identyfikacja odczynów roztworów wodnych
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
W probówkach oznaczonych numerami 1., 2. i 3. umieszczono w przypadkowej kolejności wodne roztwory trzech soli: NaHCO3, ZnCl2 i CH3COONH4. Zbadano odczyn tych roztworów za pomocą uniwersalnych papierków wskaźnikowych. Wyniki tego badania przedstawiono w tabeli.

1. Uzupełnij tabelę. Przyporządkuj numery probówek do wzorów badanych soli.
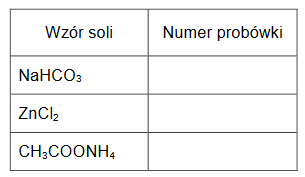
2. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.