Badanie szybkości reakcji
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
Badano szybkość reakcji opisanej równaniem
(CH3)3CCl (c) + H2O (c) → (CH3)3C(OH) (aq) + HCl (aq)
Dokończ zdanie. Wybierz odpowiedź A albo B i jej uzasadnienie 1., 2. albo 3.
Pomiar pH roztworu, w którym zachodzi opisana reakcja,

równanie syntezy chlorowodoru
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
Poniżej przedstawiono równanie syntezy chlorowodoru.
H2 (g) + Cl2 (g) ⇄ 2HCl (g) Δ𝐻𝑜 < 0
Tę reakcję prowadzono w zamkniętym reaktorze i po pewnym czasie w układzie reakcyjnym ustaliła się równowaga.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

Reakcja tlenku węgla(IV) z wodorem
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.
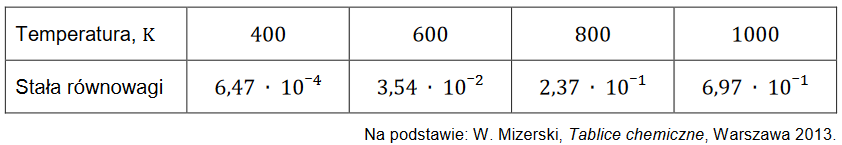
1. Rozstrzygnij, czy reakcja tlenku węgla(IV) z wodorem jest procesem endoenergetycznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
2. Do reaktora o stałej pojemności wprowadzono 10 moli tlenku węgla(IV) i 5 moli wodoru. Reaktor zamknięto i w temperaturze 800 K zainicjowano reakcję. Po pewnym czasie układ osiągnął stan równowagi.
Oblicz stosunek molowy tlenku węgla(IV) do wodoru w reaktorze po ustaleniu się stanu równowagi w temperaturze 𝟖𝟎𝟎 𝐊.
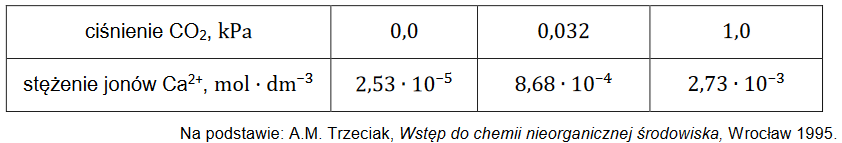
Nawozy stosowane do zasilania gleby
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
Nawozy stosowane do zasilania gleby w azot mogą powodować jej zakwaszanie i nie powinny być stosowane do nawożenia gleb kwaśnych.
Spośród wymienionych poniżej związków:
NaNO3 Ca(NO3)2 (NH4)2SO4
wybierz i zaznacz ten, który może spowodować dalsze zakwaszenie gleby kwaśnej. Napisz w formie jonowej równanie reakcji, której przebieg skutkuje zakwaszeniem
gleby przez wybrany związek. Zastosuj definicję kwasu i zasady Brønsteda.
reakcja wytrącania PbI2
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
W temperaturze 𝑇 do zlewki zawierającej 50,0 g wodnego roztworu jodku potasu o stężeniu równym 2,00 % dodano 100 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu równym 0,0300 mol ∙ dm−3. Przebiegła reakcja wytrącania PbI2. Otrzymany osad po odsączeniu i wysuszeniu ważył 1,24 g.
Oblicz wydajność reakcji otrzymywania jodku ołowiu(II) w doświadczeniu w temperaturze T.
Zapis reakcji w formie jonowej
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
Po wprowadzeniu tlenku chloru(IV) do wodnego roztworu wodorotlenku sodu zachodzi reakcja opisana schematem:
ClO2 + OH– ⟶ ClO2– + ClO3– + H2O
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania reakcji redukcji i utleniania zachodzących podczas opisanego procesu. Uwzględnij środowisko reakcji.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
Standardowej entalpia uwodornienia
Arkusz z chemii rozszerzonej czerwiec 2024 stara formuła
W tabeli podano wartości standardowej entalpii uwodornienia: cykloheksenu, cykloheksa-1,3-dienu i benzenu:
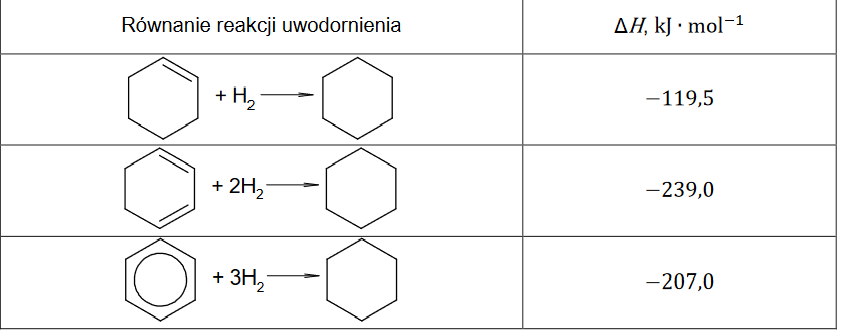
Na podstawie danych zamieszczonych w tabeli uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Gdyby wiązania 𝜋 w cząsteczce benzenu nie były zdelokalizowane, entalpia uwodornienia tego związku miałaby znacznie (niższą / wyższą) wartość niż −207,0 kJ ∙ mol−1. Delokalizacja wiązań 𝜋 skutkuje (zwiększeniem / zmniejszeniem) trwałości cząsteczki benzenu.