odmiany alotropowe węgla
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
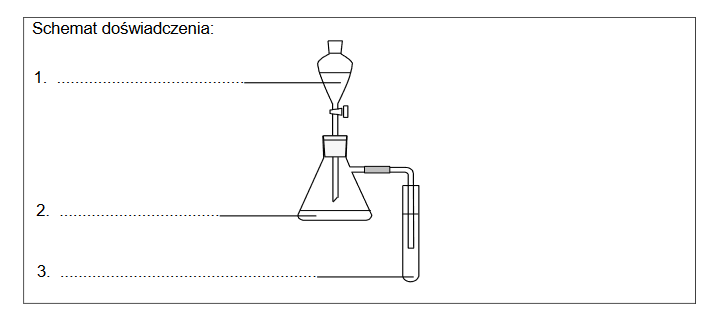
1. Poniżej przedstawiono informacje o jednej z odmian alotropowych węgla, a obok – model jej struktury krystalicznej
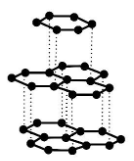
Występuje w postaci miękkiego minerału o słabym metalicznym połysku. Ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności i ciepła.
Rozstrzygnij, czy przedstawione informacje dotyczą diamentu czy grafitu. Wyjaśnij, dlaczego ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności.
Rozstrzygnięcie:
Wyjaśnienie:
2. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

identyfikacja drobin
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Z podanego zbioru:

wybierz i napisz wzór tej drobiny, w której:
1. orbitalom walencyjnym atomu centralnego przypisuje się hybrydyzację sp2.
2. atom centralny może być akceptorem pary elektronowej.
lotność związków
Arkusz z chemii rozszerzonej maj 2023 stara formuła
W poniższej tabeli podano wzory dwóch związków organicznych: alkoholu benzylowego i etylobenzenu, a także wartości masy molowej oraz temperatury wrzenia tych związków

Rozstrzygnij, który związek – alkohol benzylowy czy etylobenzen – jest substancją bardziej lotną. Wyjaśnij, dlaczego alkohol benzylowy i etylobenzen znacznie różnią się wartościami temperatury wrzenia. Odnieś się do wpływu różnicy w budowie cząsteczek obu związków na ich właściwości fizykochemiczne.
Rozstrzygnięcie:
Wyjaśnienie:
stężeniowa stała równowagi reakcji rozkładu i syntezy
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Reakcja rozkładu chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
2BrCl (g) ⇄ Br2 (g) + Cl2 (g)
Wartość stężeniowej stałej równowagi reakcji rozkładu chlorku bromu(I) w temperaturze 500 K jest równa 32.
Na podstawie: L. Jones, P. Atkins, Chemia ogólna, Warszawa 2009.
Reakcja syntezy chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
Br2 (g) + Cl2 (g) ⇄ 2BrCl (g)
Oblicz wartość stężeniowej stałej równowagi reakcji syntezy chlorku bromu(I) w temperaturze 𝟓𝟎𝟎 𝐊.
proces dysocjacji
Arkusz z chemii rozszerzonej maj 2023 stara formuła
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze.
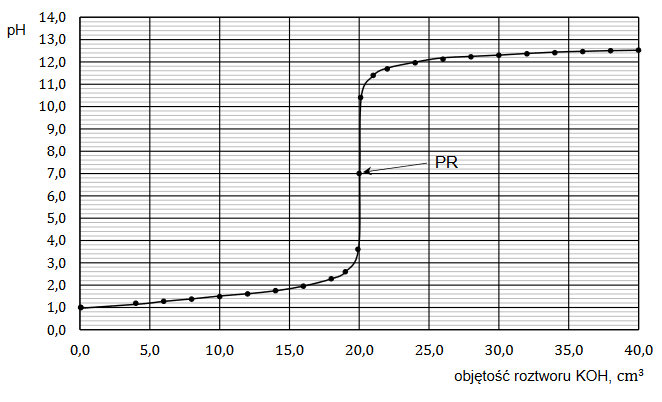
Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (α) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20°C.
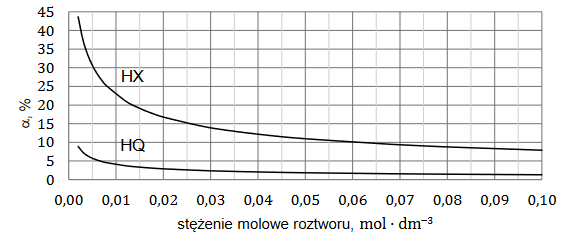
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij.
HX HQ
Uzasadnienie:
pary kwas – zasada Brønsteda
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Spośród wymienionych par drobin wybierz i zaznacz wszystkie te, które nie tworzą sprzężonej pary Brønsteda kwas – zasada.
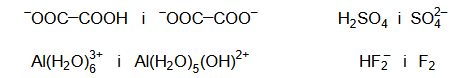
definicja kwasu i zasady Brønsteda
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
• do probówki 1. – kilka kropel roztworu fenoloftaleiny
• do probówki 2. – nadmiar stężonego HCl (aq).
1. Zawartość probówki 1., po dodaniu do niej roztworu fenoloftaleiny, zabarwiła się na kolor czerwonoróżowy (malinowy).
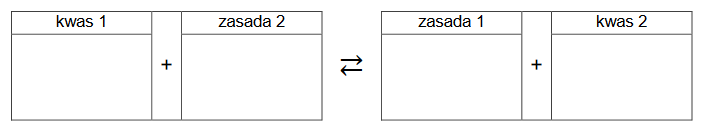
Wpisz do schematu wzory odpowiednich drobin tak, aby powstało równanie procesu decydującego o odczynie roztworu w probówce 1. Zastosuj definicję kwasu i zasady
Brønsteda.
2. Napisz, co zaobserwowano podczas doświadczenia w probówce 2. po dodaniu odczynnika. Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną zaobserwowanych zmian.
Obserwacje:
Równanie reakcji:
rozpuszczalność amoniaku w wodzie
Arkusz z chemii rozszerzonej maj 2023 stara formuła
W temperaturze 25 °C rozpuszczalność amoniaku w wodzie jest równa 46 g w 100 g wody.
Na podstawie: K. H. Lautenschläger i in., Nowoczesne kompendium chemii, Warszawa 2007.
Oblicz pH wodnego roztworu amoniaku nasyconego w tej temperaturze, jeżeli jego gęstość jest równa 𝟎, 𝟗𝟏 𝐠 ∙ 𝐜𝐦–𝟑. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie odczynu roztworów
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Wymieszano po dwa wodne roztwory różnych soli o stężeniu ok. 0,5 mol ∙ dm−3. W ten sposób otrzymano roztwory A i B, których skład podany jest w poniższej tabeli.
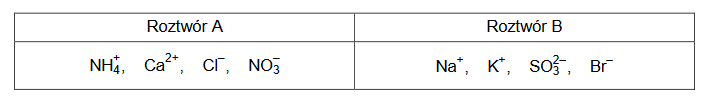
Określ odczyn roztworów A i B.
Odczyn roztworu A:
Odczyn roztworu B:
określanie odczynu różnych roztworów
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Przygotowano wodne roztwory następujących substancji:
1. kwasu azotowego(V) o stężeniu 0,5 mol ∙ dm−3
2. kwasu octowego (etanowego) o stężeniu 0,5 mol ∙ dm−3
3. wodorotlenku baru o pH = 11
4. wodorotlenku potasu o pH = 11.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wartość pH roztworu kwasu azotowego(V) jest (większa niż / mniejsza niż / taka sama jak) wartość pH roztworu kwasu octowego.
Spośród roztworów o odczynie zasadowym mniejsze stężenie molowe ma roztwór numer (3 / 4).