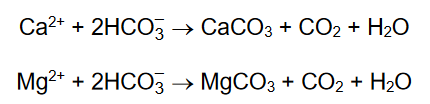konfiguracja elektronowa atomów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Poniżej przedstawiono konfigurację elektronową atomów czterech pierwiastków (I – IV):
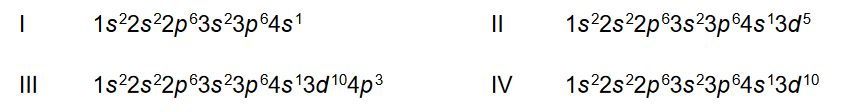
Napisz, która z przedstawianych konfiguracji elektronowych opisuje atom w stanie wzbudzonym. Odpowiedź uzasadnij.
Konfiguracja:
Uzasadnienie:
otrzymywanie izotopu tenesu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Tenes – pierwiastek chemiczny o liczbie atomowej Z = 117 – otrzymano w reakcji jądrowej między 48Ca i 249Bk. W tym procesie powstały dwa izotopy tenesu, przy czym reakcji tworzenia jądra jednego z tych izotopów towarzyszyła emisja 3 neutronów. Ten izotop ulegał dalszym przemianom: w wyniku kilku kolejnych przemian α otrzymano dubn – 270Db.
Napisz równanie reakcji otrzymywania opisanego izotopu tenesu – uzupełnij wszystkie pola w poniższym schemacie. Napisz, w wyniku ilu przemian 𝛂 ten izotop tenesu przekształcił się w 270Db.
Otrzymywanie izotopu tenesu:
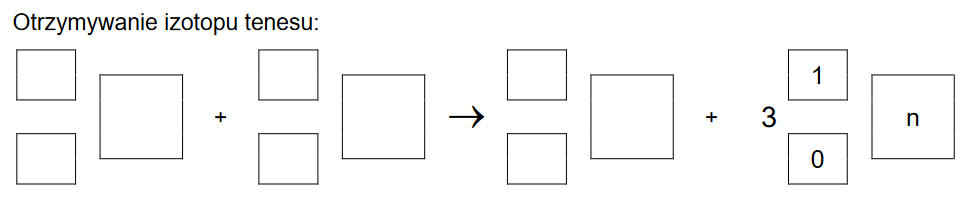
Liczba przemian α:
Budowa atomu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
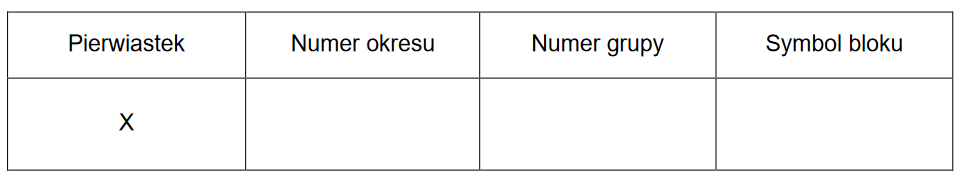
Na podstawie budowy atomów pierwiastków należących do grup 1.–2. oraz 13.–17. drugiego okresu układu okresowego uzupełnij poniższe zdanie. W wyznaczone miejsca wpisz symbol albo nazwę odpowiedniego pierwiastka.
Spośród pierwiastków drugiego okresu:
• najmniejszy ładunek jądra ma atom:
• najmniejszy promień atomowy ma atom:
• najmniejszą wartość pierwszej energii jonizacji ma atom:
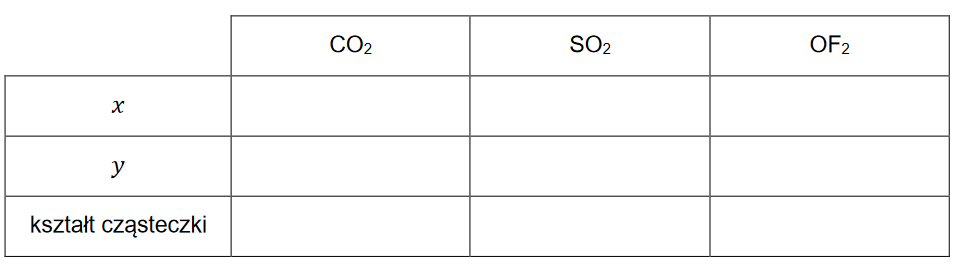
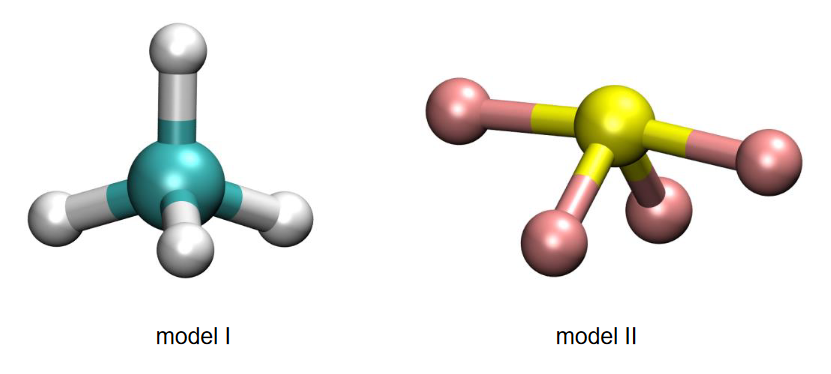
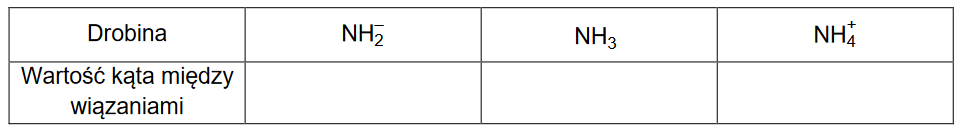
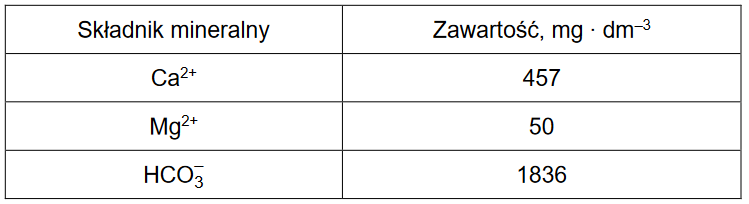
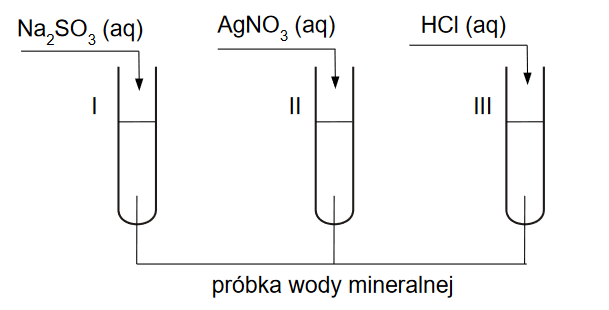
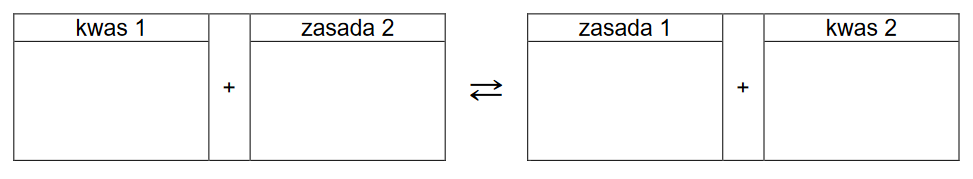
Reakcje w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Do zlewki wprowadzono 80 cm3 roztworu mocnego (całkowicie zdysocjowanego), jednoprotonowego kwasu HA o stężeniu 0,10 mol · dm–3. Następnie do zlewki wprowadzono 45 cm3 roztworu wodorotlenku potasu o stężeniu 0,15 mol · dm–3. Do takiej mieszaniny dodawano kroplami roztwór wodorotlenku sodu o stężeniu 0,2 mol · dm–3 do momentu uzyskania roztworu o pH równym 2,1.
Oblicz objętość dodanego roztworu wodorotlenku sodu. Przyjmij, że objętość mieszaniny była sumą objętości zmieszanych roztworów.
Obliczenia z reaktora
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Do reaktora wprowadzono próbkę N2O4 o masie równej 4,14 g. W reaktorze utrzymywano stałe ciśnienie równe 1000 hPa i stałą temperaturę 298 K, natomiast zmianie mogła ulegać pojemność. W warunkach prowadzenia eksperymentu ustaliła się równowaga chemiczna opisana równaniem:
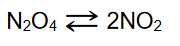
Objętość mieszaniny obu tlenków, po ustaleniu się stanu równowagi, była równa 1,32 dm3.
Oblicz stężeniową stałą równowagi Kc przemiany w opisanych warunkach. Stała gazowa R = 83,14 hPa · dm3 · mol–1 · K–1. Przyjmij, że NO2 i N2O4 są gazami doskonałymi.
Równanie kinetyczne reakcji – obliczenia
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Równanie kinetyczne reakcji opisanej równaniem:
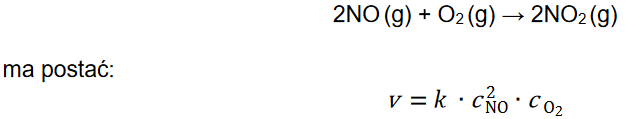
Szybkość reakcji chemicznej v, wyrażona w jednostce: mol *dm−3 * s−1, zależy od stężeń molowych substratów reakcji oraz od stałej szybkości reakcji 𝑘 – współczynnika charakterystycznego dla danej reakcji. Stała szybkości reakcji zależy od temperatury, a nie zależy od stężenia substratów.
1. Napisz jednostkę stałej szybkości reakcji 𝒌 w równaniu kinetycznym opisanej reakcji.
2. W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole tlenu. Podczas reakcji utrzymywano stałą temperaturę T.
Oblicz, ile razy zmaleje szybkość opisanej reakcji w stosunku do szybkości
początkowej, w momencie, w którym stężenie tlenu zmniejszy się o 1 mol * dm−3.
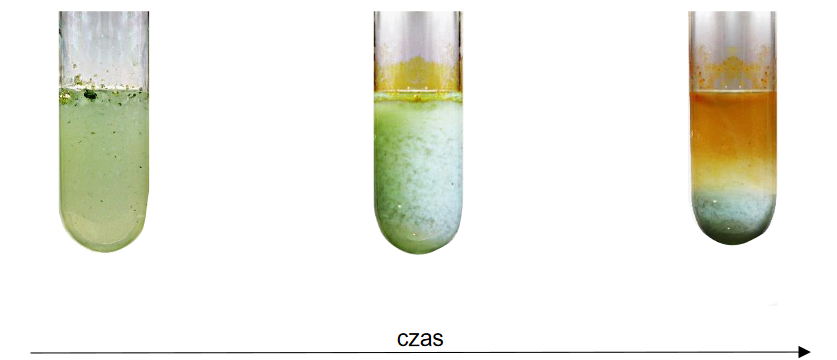
Reakcje w rozworze wodnym z wytworzeniem osadu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Wykonano doświadczenie, którego celem było otrzymanie pewnej substancji chemicznej.
Postępowano zgodnie z poniższą instrukcją:
Odważyć 5 g CuSO4·5H2O, umieścić w kolbie stożkowej i dodać 15 cm3 wody destylowanej.
Roztwór w kolbie mieszać i ogrzać w łaźni wodnej do temperatury około 60 °C.
W tej temperaturze dodawać powoli porcjami nadmiar pyłu cynkowego (ok. 1,5 g).
Po wprowadzeniu całej ilości cynku kolbę dalej ogrzewać do momentu odbarwienia roztworu.
Następnie otrzymaną mieszaninę przesączyć i osad przemyć rozcieńczonym kwasem
solnym (0,5 mol · dm–3).
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną odbarwienia roztworu, i wyjaśnij, w jakim celu otrzymany osad należy przemyć rozcieńczonym kwasem solnym.
Równanie zachodzącej reakcji:
Wyjaśnienie:
standardowe półogniwo
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
W standardowym półogniwie A ustala się równowaga opisana równaniem:
MnO4− + 8H+ + 5e− ⇄ Mn2+ + 4H2O
Po połączeniu tego półogniwa ze standardowym półogniwem B otrzymano ogniwo, którego siła elektromotoryczna (SEM) jest równa 0,971 V.
Napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.