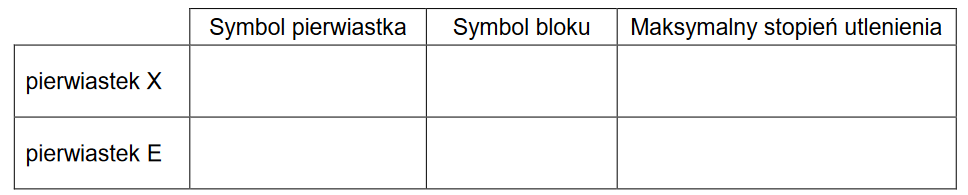
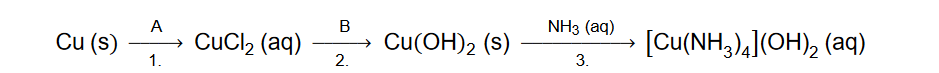Budowa atomu – promienie atomowe
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
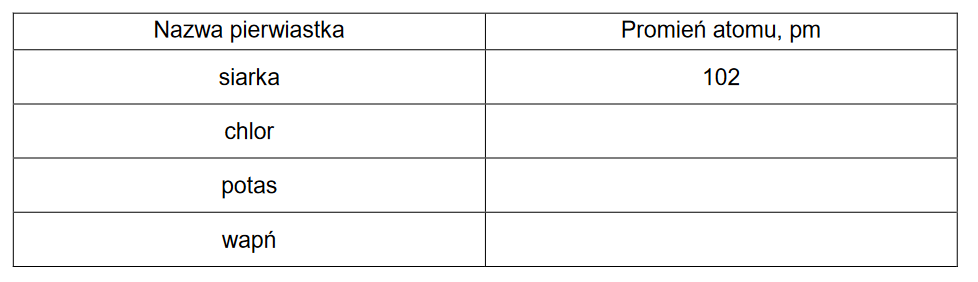
W poniższej tabeli podano wartości promieni atomowych r1, r2, r3 i r4 atomów czterech pierwiastków.
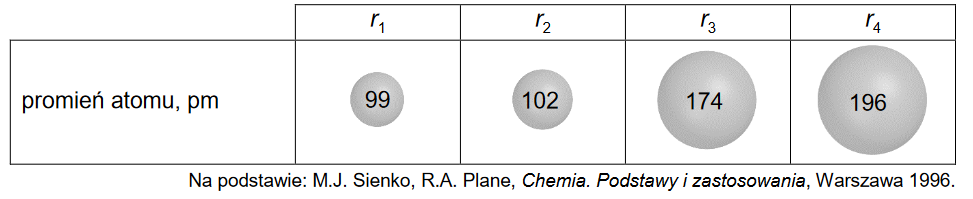
Uzupełnij poniższą tabelę. Na podstawie zmienności promieni atomów w grupach i okresach przyporządkuj wymienionym pierwiastkom wartości promieni atomowych ich atomów.
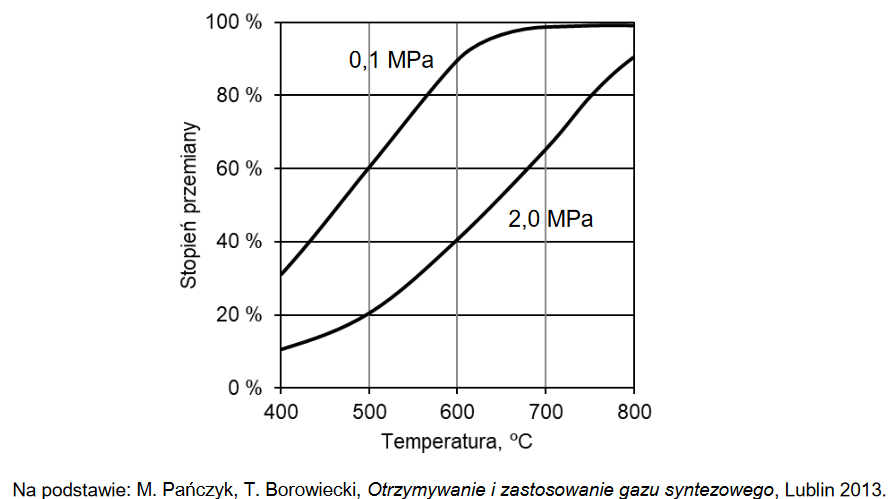
obliczenia w reaktorze
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do reaktora o pojemności 1,0 dm3 wprowadzono pewną liczbę moli substancji A oraz pewną liczbę moli substancji B. Reaktor zamknięto i zainicjowano reakcję chemiczną, która przebiegała w stałej temperaturze T zgodnie z równaniem:
A (g) + B (g) ⇄ C (g) + D (g)
Do momentu ustalenia stanu równowagi przereagowało 20 % substancji A. W tych warunkach stężeniowa stała równowagi opisanej reakcji jest równa 2,0.
Oblicz, jaki procent liczby moli wyjściowej mieszaniny stanowiła substancja A.
Nadtlenek sodu i jego reakcje
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Produktem spalania metalicznego sodu w tlenie jest nadtlenek sodu o wzorze Na2O2. W wyniku reakcji tego związku z sodem w podwyższonej temperaturze można otrzymać tlenek sodu Na2O. Każdy z opisanych związków sodu z tlenem ma budowę jonową i tworzy sieć krystaliczną zbudowaną z kationów i anionów.
Nadtlenek sodu reaguje gwałtownie z wodą. Jednym z produktów tej reakcji, zachodzącej bez zmiany stopni utlenienia, jest nadtlenek wodoru H2O2.
1. Napisz wzór anionu występującego w nadtlenku sodu oraz wzór anionu występującego w tlenku sodu.
Wzór anionu w nadtlenku sodu:
Wzór anionu w tlenku sodu:
2. Napisz w formie cząsteczkowej równanie reakcji nadtlenku sodu z wodą.
reakcje REDOX
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
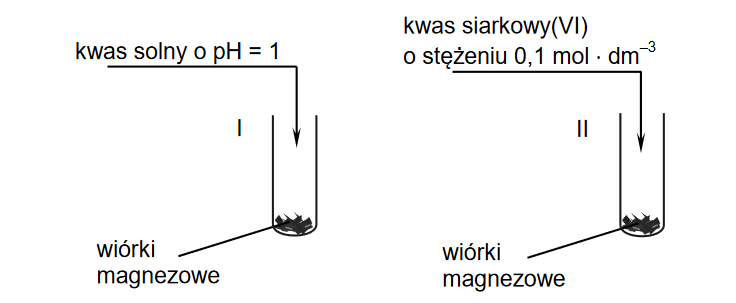
Przeprowadzono doświadczenie zilustrowane schematem.
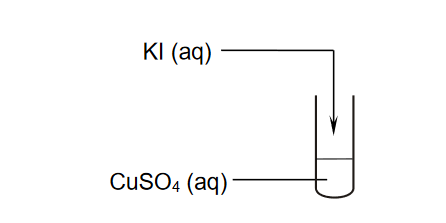
Po zmieszaniu obu roztworów zaszła reakcja utleniania i redukcji, w wyniku której wytrącił się biały osad jodku miedzi(I) i wydzielił się wolny jod.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła po zmieszaniu roztworów KI i CuSO4.
Produkty redukcji związków manganu(VII) w zależności od środowiska
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
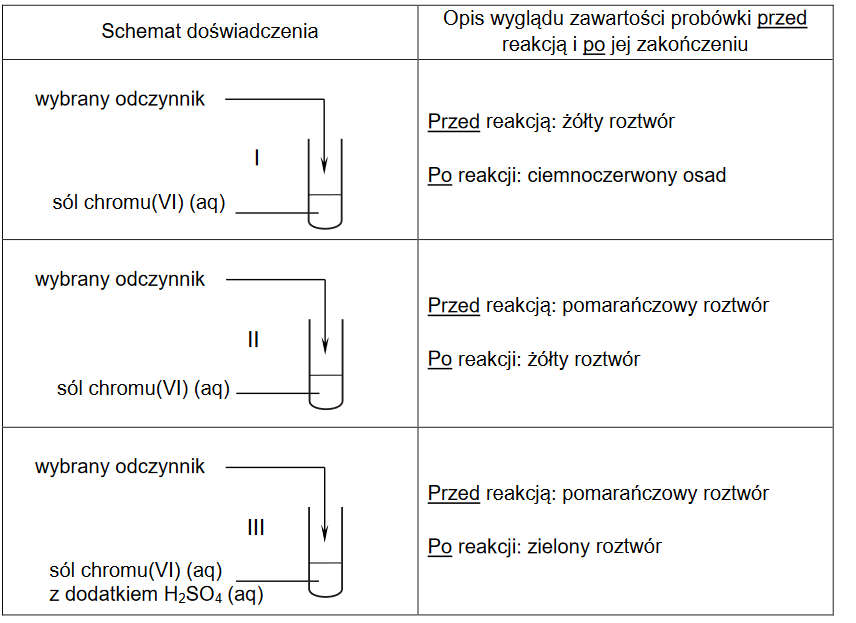
Wykonano doświadczenie zilustrowane poniższym schematem.
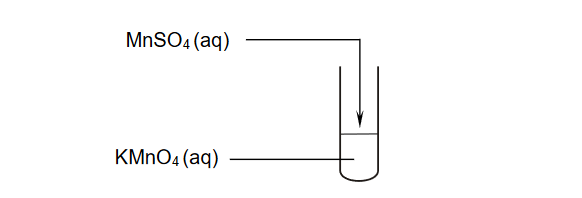
Po zakończeniu reakcji w probówce widoczne były bezbarwny roztwór i brunatny osad.
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo–elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Uwzględnij, że reakcja zachodzi w środowisku obojętnym.
Równanie procesu redukcji:
Równanie procesu utleniania:
obliczenia związane z rozcieńczaniem roztworów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do 1,00 dm3 wody destylowanej wprowadzono 90,0 cm3 wodnego roztworu kwasu azotowego(V) o stężeniu 5,00 % masowych i gęstości równej 1,03 g * cm–3.
Oblicz pH otrzymanego roztworu kwasu azotowego(V). W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworu i wody. Wynik zaokrąglij do drugiego miejsca po przecinku.
przewidywanie odczynu roztworu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Zmieszano wodny roztwór kwasu azotowego(V) z wodnym roztworem wodorotlenku potasu w stosunku objętościowym vHNO3 : vKOH = 2 : 1. Otrzymano klarowny roztwór o pH = 7.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.