identyfikacja pierwiastków chemicznych
Arkusz z chemii rozszerzonej maj 2021
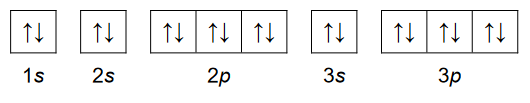
Dwa pierwiastki, oznaczone numerami 1. i 2., należą do czwartego okresu układu okresowego. Liczba atomowa pierwiastka 1. jest mniejsza od liczby atomowej pierwiastka 2. Atomy (w stanie podstawowym) tych pierwiastków mają 4 elektrony, które mogą uczestniczyć w tworzeniu wiązań chemicznych.
Uzupełnij tabelę. Napisz nazwy pierwiastków 1. i 2. oraz określ, czy w atomach (w stanie podstawowym) tych pierwiastków występują niesparowane elektrony – podaj liczbę elektronów niesparowanych i napisz symbol podpowłoki, do której one należą, albo zaznacz, że nie ma takich elektronów.

reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
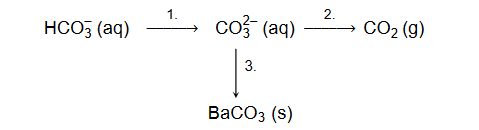
1. Spośród wymienionych odczynników
● wodorotlenek potasu
● kwas etanowy
● siarczan(VI) baru
● azotan(V) baru
wybierz i wpisz do tabeli nazwy lub wzory tych substancji, które mogły być użyte w poszczególnych etapach opisanego schematem ciągu przemian.
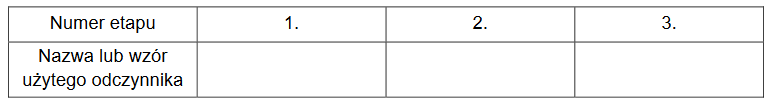
2. Napisz w formie jonowej skróconej równania reakcji oznaczonych na schemacie numerami 1. i 2.
Równanie reakcji 1.:
Równanie reakcji 2.:
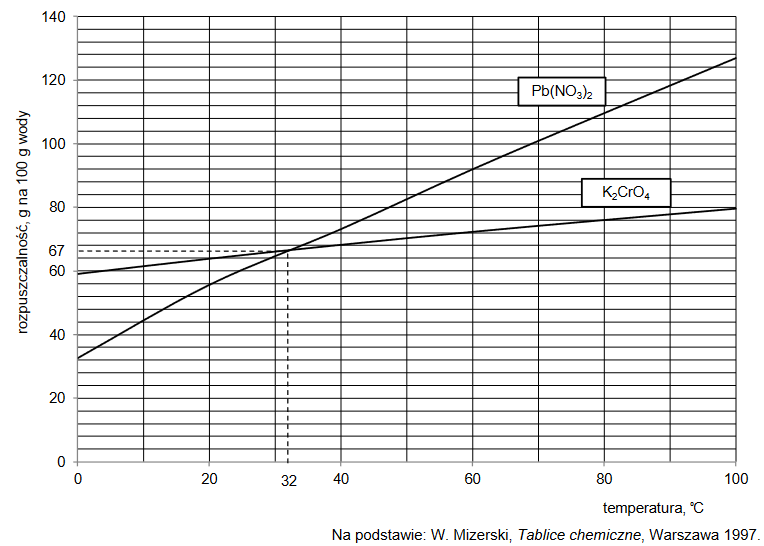
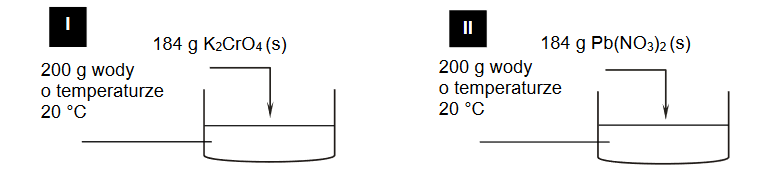
Roztwory i reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
Do 20 cm3 wodnego roztworu HCl o pH = 1,0 dodano 30 cm³ wodnego roztworu NaOH o stężeniu 0,060 mol∙dm⁻³. Po zmieszaniu roztworów przebiegła reakcja chemiczna opisana
równaniem:
H3O⁺ + OH⁻ → 2H₂O
Wykonaj odpowiednie obliczenia i napisz, ile razy zmalało stężenie jonów hydroniowych H3O⁺ po dodaniu roztworu NaOH. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Kwas arsenowy(V) H3 AsO4 – kwas trójprotonowy
Arkusz z chemii rozszerzonej maj 2021
Kwas arsenowy(V) H3 AsO4 jest kwasem trójprotonowym o mocy zbliżonej do kwasu ortofosforowego(V). Równowagom, które ustalają się w roztworze wodnym tego kwasu, odpowiadają stałe opisane poniższymi wyrażeniami (podanymi w przypadkowej kolejności), w których została pominięta woda będąca środowiskiem reakcji.
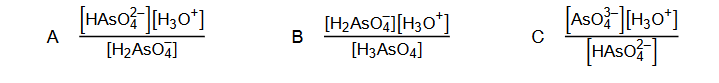
Uszereguj stałe równowagi (wpisz litery A, B oraz C) zgodnie z ich rosnącą wartością. Napisz równanie przemiany, której odpowiada stała równowagi opisana wyrażeniem A. Spośród jonów powstających podczas protolizy (dysocjacji) kwasu arsenowego(V) wybierz i napisz wzór tego, który może pełnić wyłącznie funkcję kwasu Brønsteda.
najmniejsza wartość: – największa wartość:
Równanie reakcji:
Jon, który może pełnić wyłącznie funkcję kwasu Brønsteda:
planowanie i opisywanie doświadczeń
Arkusz z chemii rozszerzonej maj 2021
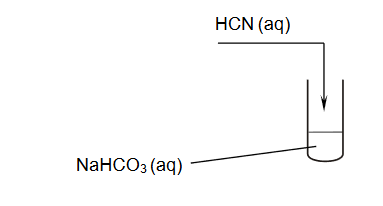
W dwóch probówkach znajdowały się wodne roztwory soli X i Z, otrzymane przez rozpuszczenie stałych soli, z których jedną był siarczek potasu, a drugą – bromek potasu. Przeprowadzono doświadczenie zgodnie z poniższym schematem. W doświadczeniu użyto świeżo otrzymanej wody chlorowej.
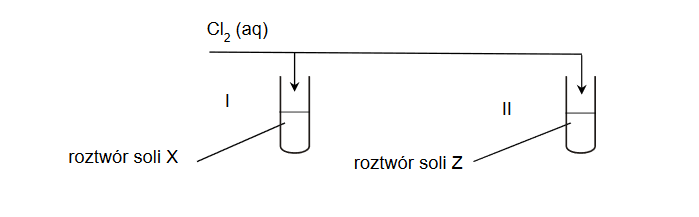
Po dodaniu wody chlorowej do probówek zauważono, że w probówce I roztwór zmienił barwę,
ale pozostał klarowny, natomiast w probówce II pojawiło się zmętnienie.
1. Zidentyfikuj sole X i Z i wpisz ich wzory do tabeli.
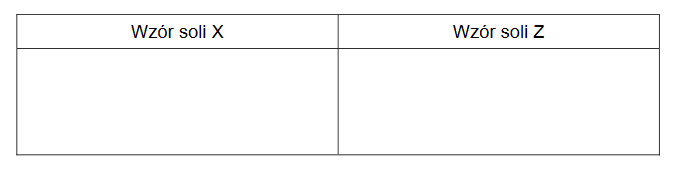
2. Napisz w formie jonowej skróconej równania reakcji pomiędzy chlorem a bromkiem potasu oraz pomiędzy chlorem a siarczkiem potasu.
właściwości chemiczne metali wobec rozcieńczonych i stężonych roztworów kwasów
Arkusz z chemii rozszerzonej maj 2021
W dwóch nieoznaczonych probówkach znajdowały się oddzielnie: rozcieńczony wodny roztwór kwasu azotowego(V) i rozcieńczony wodny roztwór kwasu siarkowego(VI). W tych roztworach zanurzono blaszki miedziane, a zawartość probówek lekko ogrzano.
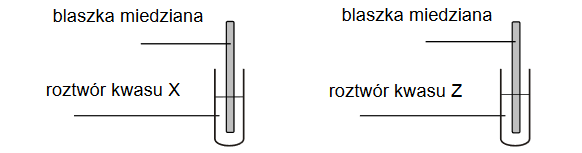
Po zanurzeniu blaszki miedzianej w roztworze kwasu X i ogrzaniu zawartości probówki wydzielał się bezbarwny gaz, który w kontakcie z powietrzem zabarwiał się na kolor czerwonobrunatny.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
W rozcieńczonym roztworze kwasu azotowego(V) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje) i roztwór (przyjmuje barwę
niebieską / pozostaje bezbarwny). W rozcieńczonym roztworze kwasu siarkowego(VI) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje)
i roztwór (przyjmuje barwę niebieską / pozostaje bezbarwny). Kwasem X jest (HNO3 / H2 SO4).