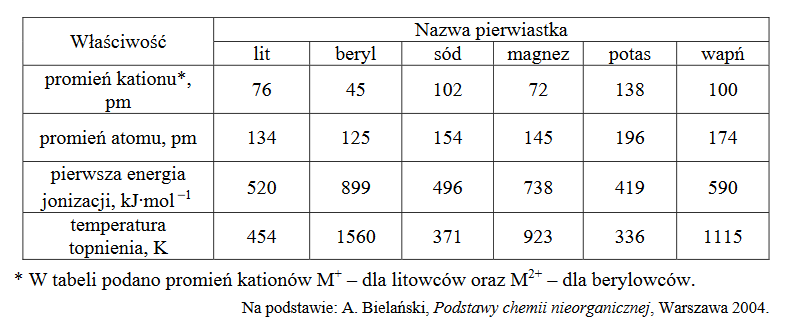
Atom pewnego pierwiastka
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Atom pewnego pierwiastka ma w stanie podstawowym niesparowany elektron walencyjny na podpowłoce p trzeciej powłoki.
Spośród wymienionych pierwiastków wybierz ten, którego dotyczy powyższy opis.
Zaznacz nazwę tego pierwiastka.
A. Sód.
B. Skand.
C. Miedź.
D. Chlor.
różne stany energetyczne atomów pierwiastków chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Poniższe schematy I i II przedstawiają konfigurację elektronową dla orbitali walencyjnych atomu pewnego pierwiastka chemicznego X w różnych stanach energetycznych.

Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek. Napisz, który schemat konfiguracji elektronowej (I albo II) opisuje stan podstawowy atomu pierwiastka X.

Stan podstawowy atomu pierwiastka X opisuje schemat numer ……..
energia potencjalna cząsteczek metanu
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Na poniższym wykresie przedstawiono, jak zmienia się energia potencjalna cząsteczek metanu w zależności od dzielącej je odległości (linia ciągła oznaczona numerem 1).
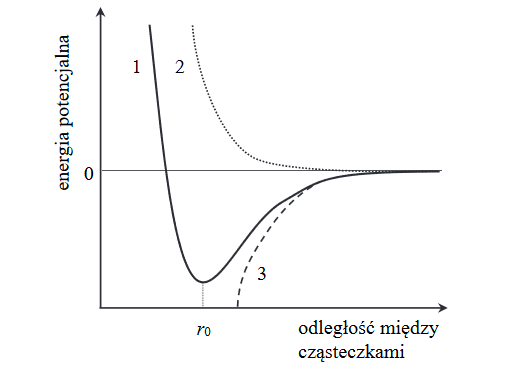
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W miarę zbliżania się do siebie cząsteczek metanu siły przyciągania van der Waalsa rosną, co skutkuje spadkiem energii potencjalnej cząsteczek zilustrowanym krzywą oznaczoną numerem (2 / 3). Jednocześnie w miarę zbliżania się do siebie cząsteczek metanu siły odpychania między jądrami atomowymi i siły odpychania między elektronami dwóch cząsteczek (rosną / maleją). Najbardziej korzystny energetycznie dla cząsteczek metanu jest stan, w którym odległość między nimi jest (mniejsza niż r0 / równa r0 / większa od r0 ).
najbardziej znane odmiany alotropowe węgla – diament i grafit
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Diament i grafit to najbardziej znane odmiany alotropowe węgla.
Oceń, czy poniższe informacje dotyczące diamentu i grafitu są prawdziwe.
Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

stężenie równowagowe
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W pewnych warunkach ciśnienia i temperatury w trzech reaktorach (I, II i III) ustalił się stan równowagi reakcji zilustrowanych równaniami:
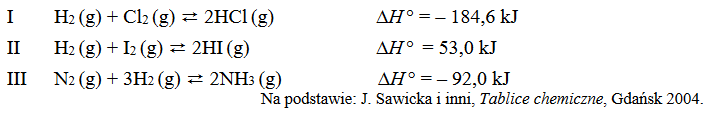
Napisz numer reaktora, w którym pod wpływem wzrostu ciśnienia (T = const) wzrosło stężenie równowagowe odpowiedniego wodorku, oraz numer reaktora, w którym pod wpływem wzrostu temperatury (p = const) wzrosło stężenie równowagowe odpowiedniego wodorku.
Wzrost ciśnienia skutkuje wzrostem stężenia równowagowego wodorku w reaktorze ….. .
Wzrost temperatury skutkuje wzrostem stężenia równowagowego wodorku w reaktorze ….. .
budowa kowalencyjna związków chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Jodowodór HI, metan CH4 i siarkowodór H2 S mają budowę kowalencyjną. Wszystkie te wodorki w warunkach normalnych są gazami.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

reakcja w zamkniętym reaktorze
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W zamkniętym reaktorze znajdowały się dwa gazy: wodór oraz fluor. Po zakończeniu reakcji zbiornik zawierał tylko fluorowodór, którego masa była równa 0,4 g.
Napisz, w jakim stosunku objętościowym zmieszano wodór z fluorem w reaktorze, oraz określ, ile gramów wodoru i ile gramów fluoru wprowadzono do reaktora.
Stosunek objętości substratów V wodoru : V fluoru = ……
Masa wodoru wprowadzonego do reaktora m wodoru = ……
Masa fluoru wprowadzonego do reaktora m fluoru =……
kwasy i zasady Brønsteda
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Kwas fosfonowy o wzorze sumarycznym H₃PO₃ jest kwasem dwuprotonowym, którego wzór można zapisać jako H₂PHO₃. Struktura cząsteczki tego kwasu jest następująca:
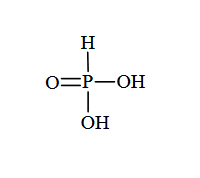
Napisz równanie reakcji ostatniego etapu dysocjacji kwasu H 2 PHO3 w wodzie w ujęciu teorii Brønsteda. Określ, jaką funkcję – kwasu czy zasady Brønsteda – pełni w tej reakcji woda.
Równanie reakcji:
Funkcja wody:
Produkcja krzemu w piecu elektrycznym
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Produkcja krzemu w skali przemysłowej polega na redukcji tlenku krzemu(IV) węglem w piecu elektrycznym w temperaturze około 2300 K. Reakcja zachodzi zgodnie z równaniem:
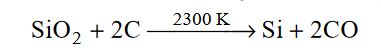
Oblicz, ile kilogramów czystego krzemu można otrzymać z 1 tony piasku kwarcowego zawierającego 85% masowych tlenku krzemu(IV), jeżeli wydajność procesu jest równa 70%. Przyjmij, że pozostałe składniki piasku nie zawierają krzemu.
Uwodniony węglan sodu – bezbarwny kryształ
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Węglan sodu występuje w postaci soli bezwodnej oraz w postaci hydratu zawierającego 63% masowych wody. Obie formy rozpuszczają się w wodzie. Uwodniony węglan sodu tworzy
bezbarwne kryształy, które podczas ogrzewania uwalniają wodę krystalizacyjną i rozpuszczają się w niej.
Rozpuszczalność węglanu sodu (w przeliczeniu na sól bezwodną) w temperaturze 40 °C jest równa 48,8 g na 100 g wody.
1. Wykonaj obliczenia i ustal wzór opisanego hydratu węglanu sodu.
2. Na podstawie obliczeń rozstrzygnij, czy węglan sodu zawarty w opisanym hydracie całkowicie rozpuści się w wodzie krystalizacyjnej w temperaturze 40 °C.
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

porównania mocy substancji chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W celu porównania mocy kwasu siarkowego(VI), fenolu, kwasu etanowego i kwasu węglowego przeprowadzono doświadczenie zilustrowane poniższym schematem. Wszystkie użyte roztwory zostały świeżo przygotowane.
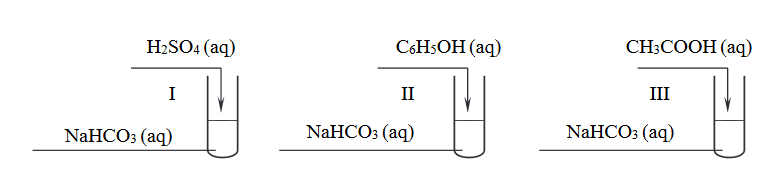
W probówkach I i III zaobserwowano wydzielanie się pęcherzyków gazu, a w probówce II – po zmieszaniu wodnych roztworów użytych do doświadczenia – nie przebiegła reakcja wodorowęglanu sodu z fenolem.
1. Sformułowane obserwacje i wnioski nie pozwalają na jednoznaczne określenie mocy badanych kwasów.
Jaką reakcję chemiczną należy dodatkowo przeprowadzić, aby możliwe było uszeregowanie wszystkich badanych kwasów od najsłabszego do najmocniejszego? Uzupełnij schemat – wybierz i podkreśl wzór jednego odczynnika z zestawu I oraz wzór jednego odczynnika z zestawu II.
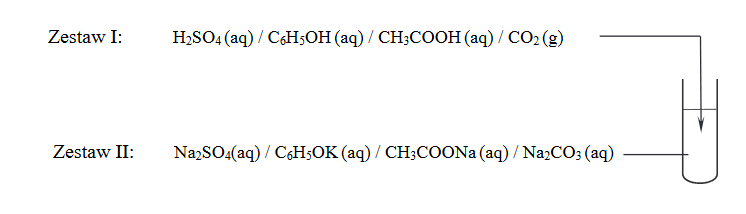
2. Napisz w formie cząsteczkowej równanie reakcji zachodzącej podczas dodatkowego doświadczenia.
rozpuszczalniki amfiprotycznymi – rozpuszczalniki, których cząsteczki mogą zarówno odszczepiać, jak i przyłączać proton
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Rozpuszczalnikami amfiprotycznymi nazywa się rozpuszczalniki, których cząsteczki mogą zarówno odszczepiać, jak i przyłączać proton. Do rozpuszczalników amfiprotycznych należą m.in. woda, ciekłe alkohole oraz kwasy karboksylowe, ciekły amoniak i aminy.
W rozpuszczalnikach amfiprotycznych ustala się stan równowagi reakcji autoprotolizy, która dla wody zachodzi zgodnie z równaniem:
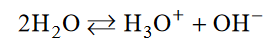
Reakcję autoprotolizy rozpuszczalnika opisuje stała równowagi nazywana iloczynem jonowym rozpuszczalnika, np. iloczyn jonowy wody wyraża się równaniem:
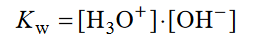
1. Iloczyn jonowy wody w temperaturze 80 ºC ma wartość Kw = 25 ⋅ 10⁻¹⁴.
Oblicz pH wody w temperaturze 80 ºC. Wynik podaj z dokładnością do jednego miejsca po przecinku.
2. Poniżej zestawiono wartości iloczynu jonowego trzech rozpuszczalników w temperaturze 25ºC.
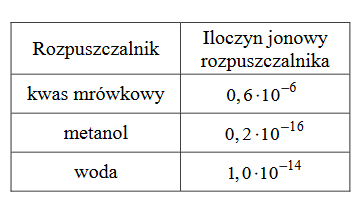
Uszereguj wymienione rozpuszczalniki według wzrastającego stopnia ich autoprotolizy w temperaturze 25 ºC. Napisz nazwy tych rozpuszczalników.
określanie zawartości substancji w mieszaninach – procenty masowe
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Mieszaninę azotanu(V) wapnia Ca(NO3 ) 2 i chlorku baru BaCl 2 o masie 10 g rozpuszczono całkowicie w wodzie, w wyniku czego otrzymano 100 cm3 roztworu. W celu ustalenia składu mieszaniny soli pobrano 20 cm3 otrzymanego roztworu, a następnie przeprowadzono reakcję:
Ag⁺ + Cl⁻ → AgCl ↓
Na wytrącenie jonów chlorkowych zawartych w 20 cm3 roztworu zużyto 40 cm3 wodnego roztworu azotanu(V) srebra AgNO3 o stężeniu 0,3 mol∙dm⁻³ .
Oblicz w procentach masowych zawartość azotanu(V) wapnia i chlorku baru w opisanej mieszaninie.