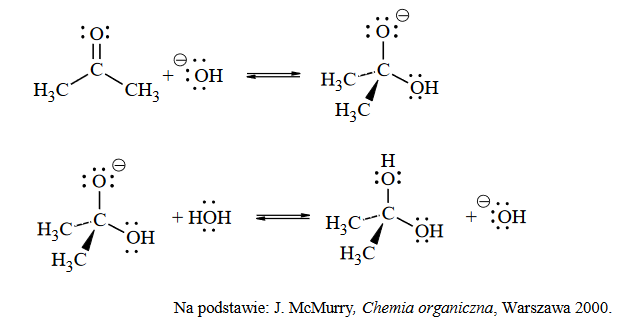
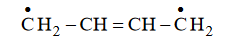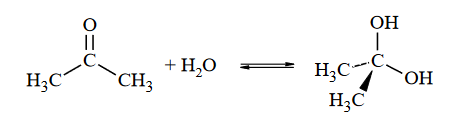rzędowość atomów węgla w cząsteczce węglowodoru
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Napisz wzór półstrukturalny (grupowy) alkanu o wzorze C₆H₁₄, w którego cząsteczce występuje czwartorzędowy atom węgla. Napisz nazwę systematyczną tego alkanu. Określ liczbę monochloropochodnych będących izomerami konstytucyjnymi, które mogą powstać w procesie chlorowcowania opisanego węglowodoru.
Wzór:
Nazwa systematyczna:
Liczba izomerycznych monochloropochodnych:
interpretacja jakościowa i ilościowa równania reakcji w ujęciu molowym
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Podczas spalania 0,25 mola pewnego węglowodoru przebiegła reakcja chemiczna zilustrowana ogólnym równaniem:
CnH2n + 1,5nO₂ → nCO₂ + nH₂O
W wyniku opisanej przemiany otrzymano 46,5 g mieszaniny tlenku węgla(IV) i pary wodnej.
Wykonaj obliczenia i zaproponuj wzór półstrukturalny (grupowy) spalanego węglowodoru.
typy hybrydyzacji w prostych cząsteczkach związków
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
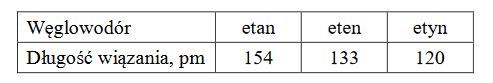
W poniższej tabeli zestawiono długości wiązania między atomami węgla w cząsteczkach etanu, etenu i etynu.
Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
W cząsteczce etanu przyjmuje się dla orbitali walencyjnych atomów węgla hybrydyzację typu (sp / sp2 / sp3). Kąt między wiązaniami wytworzonymi przez każdy atom węgla w cząsteczce etenu jest bliski (109º / 120º / 180º), a w cząsteczce etynu ten kąt jest równy (109º / 120º / 180º). Wiązanie węgiel – węgiel jest tym krótsze, im (mniejsza / większa) jest jego krotność.
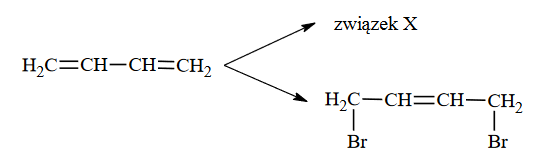
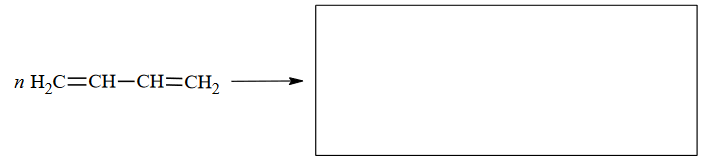
Dieny – węglowodory z podwójnymi wiązaniami węgiel – węgiel
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Dieny to węglowodory, w których cząsteczkach występują dwa podwójne wiązania węgiel – węgiel. W zależności od rozmieszczenia tych wiązań w cząsteczce dzielą się na trzy
grupy:
1) ze sprzężonym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel występują na przemian z wiązaniami pojedynczymi
2) z izolowanym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel są oddzielone od siebie więcej niż jednym wiązaniem pojedynczym
3) ze skumulowanym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel nie są oddzielone wiązaniem pojedynczym.
Poniżej przedstawiono wzory pięciu dienów oznaczone numerami I–V.
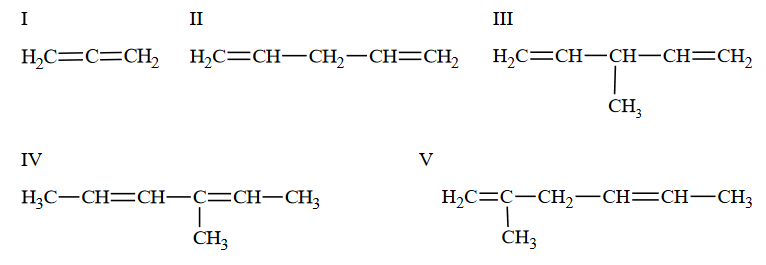
Powyższe związki podziel na dieny ze sprzężonym, izolowanym i skumulowanym układem wiązań podwójnych. Wpisz do tabeli numery, którymi oznaczono ich wzory.

obliczenia związane z przygotowaniem roztworów
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Kwas etanodiowy o wzorze (COOH)2 jest najprostszym kwasem dikarboksylowym, którego rozpuszczalność w wodzie w temperaturze 20 ºC jest równa 9,52 g bezwodnego kwasu w 100 g wody.
Oblicz minimalną masę wody potrzebną do rozpuszczenia 14,0 gramów hydratu kwasu etanodiowego o wzorze (COOH)₂ · 2H₂O w temperaturze 20 ºC. Wynik końcowy podaj w gramach i zaokrąglij do jedności.
kwas butanowy i jego monochloropochodne
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
W poniższej tabeli zestawiono wartości stałej dysocjacji (w temperaturze 25 ºC) kwasu butanowego i jego monochloropochodnych.
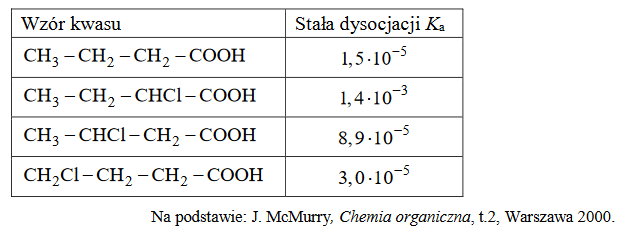
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

kwasy i zasady – klasyfikacja zgodna z teorią Brønsteda–Lowry`ego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Jon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
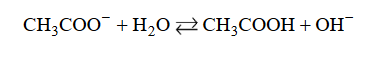
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:
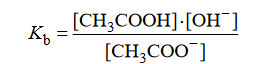
Iloczyn stałej dysocjacji kwasowej Ka kwasu CH₃COOH i stałej dysocjacji zasadowej Kb sprzężonej z nim zasady CH3COO⁻ jest równy iloczynowi jonowemu wody: Ka∙Kb = Kw. W temperaturze 25ºC iloczyn jonowy wody jest równy Kw = 1, 0 * 10⁻¹⁴.
Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 mol*dm⁻³ w temperaturze 25 ºC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych
reakcjz otrzymywania kwasów karboksylowych z aldehydów
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Reakcja utleniania propanalu odczynnikiem Tollensa przebiega zgodnie ze schematem:
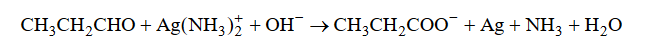
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo–elektronowy) równania procesów redukcji i utleniania
zachodzących podczas opisanej reakcji. Uwzględnij fakt, że reakcja zachodzi w środowisku zasadowym. Następnie uzupełnij schemat, tak aby otrzymać sumaryczne
równanie w formie jonowej skróconej opisanej reakcji utleniania propanalu.
Równanie procesu redukcji:
Równanie procesu utleniania:
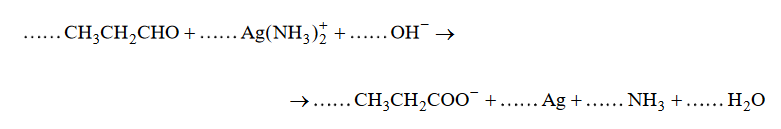
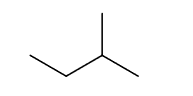
założenia teorii strukturalnej budowy związków organicznych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wzory szkieletowe związków organicznych odzwierciedlają kształt łańcucha węglowego, dlatego lepiej oddają rzeczywistą strukturę cząsteczki. Są to wzory, w których nie zapisuje się symboli atomów węgla i połączonych z nimi atomów wodoru, ale rysuje się w postaci łamanej szkielet węglowy oraz zaznacza występujące w cząsteczce wiązania wielokrotne i zapisuje wzory grup funkcyjnych oraz symbole podstawników innych niż wodór, np. wzór szkieletowy
2-metylobutanu ma postać:
Poniżej przedstawiono wzory szkieletowe trzech związków organicznych.
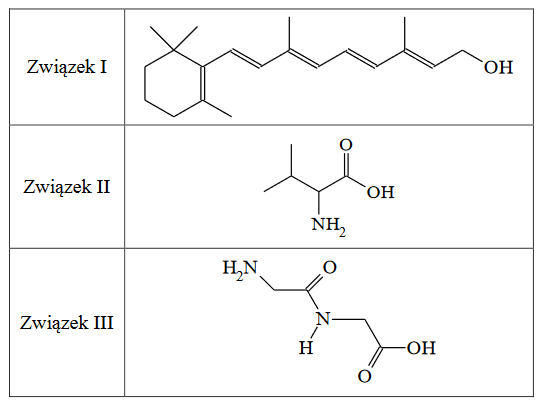
1. Napisz wzór sumaryczny związku II o wzorze szkieletowym podanym w tabeli.
2. Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

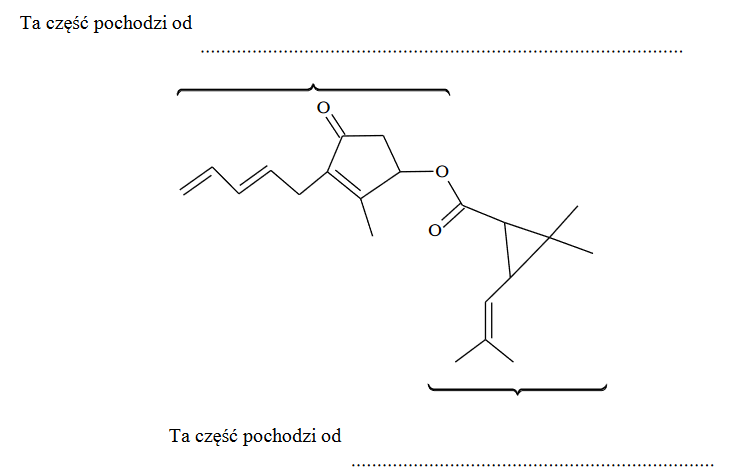
pyretryna – naturalna substancja owadobójcza
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Poniżej przedstawiono wzór szkieletowy pyretryny, która jest naturalną substancją owadobójczą wyodrębnianą z pewnej odmiany chryzantem. Ten związek jest estrem.
W poniższym wzorze szkieletowym pyretryny zakreśl fragment stanowiący wiązanie estrowe oraz podpisz część pochodzącą od kwasu i część pochodzącą od alkoholu
diamid kwasu węglowego – mocznik
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Mocznik o wzorze CO(NH2)2 jest diamidem kwasu węglowego. W wyniku ogrzewania krystalicznego mocznika wydziela się amoniak i powstaje dimocznik (biuret).
Napisz równanie opisanej reakcji prowadzącej do powstania dimocznika. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Następnie wybierz i podkreśl nazwę wiązania, które powstało w reakcji kondensacji mocznika, oraz podaj nazwę grupy związków wielkocząsteczkowych, w których występuje takie samo wiązanie.
Równanie reakcji:
Nazwa wiązania: amidowe estrowe wodorowe
Nazwa grupy związków: