symbole chemiczne pierwiastków
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wpisz do tabeli symbole chemiczne pierwiastków opisanych niżej.

Struktura atomu – jądro i elektrony
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Atomy pewnego pierwiastka oznaczonego umownie symbolem X mają w stanie podstawowym następującą konfigurację elektronową:
1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁵
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

różne stany energetyczne atomów pierwiastków chemicznych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Atom germanu w stanie podstawowym ma dwa sparowane elektrony walencyjne w podpowłoce 4s i dwa niesparowane elektrony walencyjne w podpowłoce 4p.
Oceń, czy możliwe jest obsadzenie elektronami podpowłok 4s i 4p w atomie germanu w sposób przedstawiony poniżej. Odpowiedź uzasadnij.
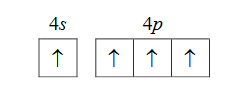
Ocena:
Uzasadnienie:
elektroujemność w skali Paulinga
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Na poniższym diagramie przedstawiono zmiany elektroujemności w skali Paulinga pierwiastków grup 1.–2. oraz 13.–17. układu okresowego (wartości elektroujemności poszczególnych pierwiastków danej grupy połączono linią ciągłą).
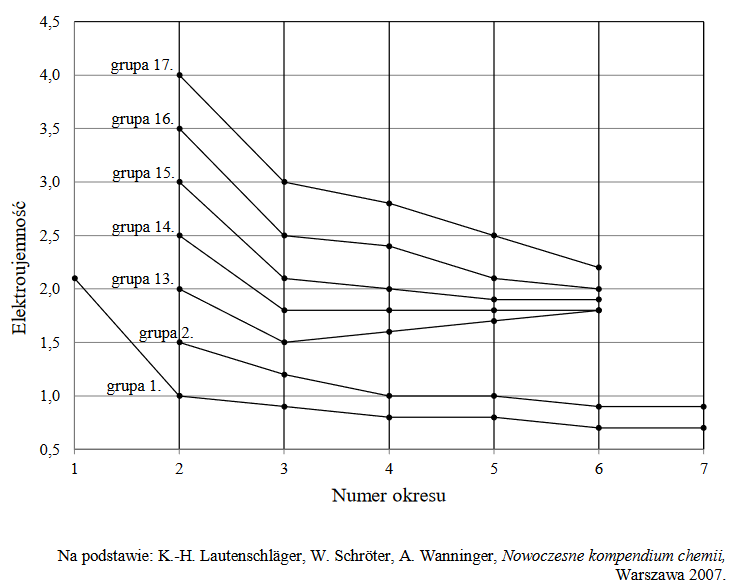
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

charakter wiązania chemicznego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Cząsteczka trichlorku fosforu o wzorze PCl3 ma budowę przestrzenną podobną do struktury cząsteczki amoniaku.
1. Określ charakter wiązania chemicznego (wiązanie kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane) w cząsteczce trichlorku fosforu i napisz wzór elektronowy tej cząsteczki. Zaznacz kreskami wiążące i wolne pary elektronowe.
Charakter wiązania:
Wzór elektronowy:
2. Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
Orbitalom walencyjnym atomu centralnego w cząsteczce trichlorku fosforu przypisuje się hybrydyzację typu (sp / sp2 / sp3). Atom centralny (nie stanowi bieguna elektrycznego /
stanowi biegun elektryczny dodatni / stanowi biegun elektryczny ujemny) w tej cząsteczce.
identyfikacja związków chemicznych rozpuszczalnych w wodzie
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Poniżej podano wzory pięciu rozpuszczalnych w wodzie związków chemicznych.
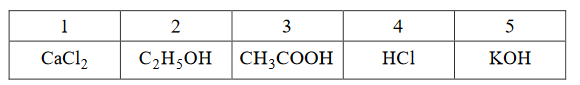
Wypełnij tabelę – wpisz numery, którymi oznaczono wzory wszystkich związków wykazujących podane w tabeli właściwości.

interpretacja jakościowej i ilościowej równania reakcji w ujęciu molowym
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
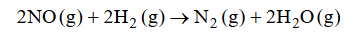
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:2
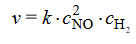
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, CNO CH₂ oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości
k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole wodoru. Podczas reakcji utrzymywano stałą temperaturę.
Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
obliczenia z uwzględnieniem wydajności reakcji i mola
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
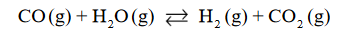
W temperaturze 800 K stężeniowa stała równowagi tej reakcji jest równa 4,0.
W zamkniętym reaktorze o stałej pojemności zmieszano 1 mol tlenku węgla(II) z parą wodną w ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano w temperaturze 800 K aż do osiągnięcia stanu równowagi dynamicznej przez układ
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Reakcja syntezy tlenku azotu(II)
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Reakcję syntezy tlenku azotu(II) ilustruje równanie:
N₂(g) + O₂(g) ⇄ 2NO (g)
W tabeli podano wartości stężeniowej stałej równowagi Kc reakcji syntezy NO w różnych temperaturach.
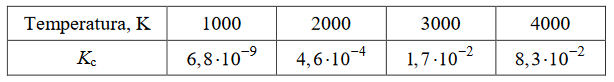
Oceń, czy opisana reakcja jest procesem egzo- czy endotermicznym, oraz spośród poniższych sposobów prowadzenia reakcji wybierz ten powodujący zwiększenie wydajności tworzenia tlenku azotu(II).
I Użycie odpowiedniego katalizatora.
II Zmniejszenie objętości mieszaniny reakcyjnej (sprężenie gazów).
III Prowadzenie reakcji w możliwie wysokiej temperaturze.
IV Prowadzenie reakcji pod możliwie niskim ciśnieniem.
Opisana reakcja jest procesem:
Numer sposobu zwiększenia wydajności tworzenia tlenku azotu(II):
właściwości fizyczne i chemiczne glinu
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Na odważkę stopu glinu z magnezem o masie 7,50 g podziałano nadmiarem rozcieńczonego kwasu solnego. Podczas roztwarzania stopu w kwasie solnym zachodziły reakcje zilustrowane równaniami:
2Al + 6HCl → 2AlCl₃ + 3H₂
Mg + 2HCl → MgCl₂ + H₂
W wyniku całkowitego roztworzenia stopu otrzymano klarowny roztwór, do którego dodano nadmiar wodnego roztworu wodorotlenku sodu. Zaszły reakcje opisane równaniami:
AlCl₃ + 6NaOH → Na₃[Al(OH)₆] + 3NaCl
MgCl₂ + 2NaOH → Mg(OH)₂ + 2NaCl
Otrzymany nierozpuszczalny w wodzie związek odsączono, przemyto wodą, wysuszono i zważono. Jego masa (w przeliczeniu na czysty wodorotlenek magnezu) była równa 11,67 g.
1. Oblicz zawartość procentową glinu w stopie (w procentach masowych).
2. Klarowny roztwór uzyskany po odsączeniu osadu Mg(OH)2 nasycono tlenkiem węgla(IV).
Zaobserwowano wytrącenie białego osadu wodorotlenku glinu.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej.
obliczenia z uwzględnieniem wydajności reakcji
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Przeprowadzono doświadczenie, w którym do czterech ponumerowanych zlewek I–IV zawierających po 100cm³ wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol dm⁻³ dodano wodne roztwory różnych substancji i wodę destylowaną zgodnie z poniższym rysunkiem.
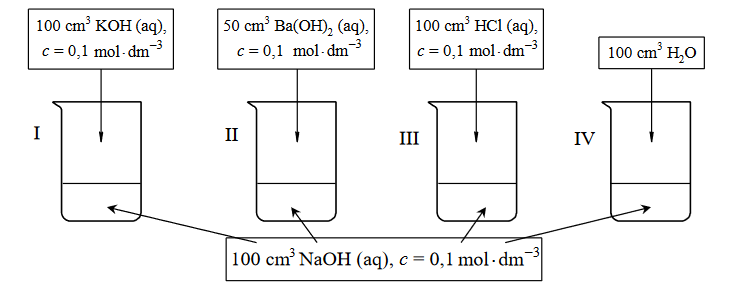
Uzupełnij poniższą tabelę – podaj wartość pH wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol ∙ dm⁻³ oraz wpisz numery zlewek, w których pH otrzymanego roztworu było niższe albo było wyższe od pH roztworu wyjściowego, albo nie uległo zmianie w czasie doświadczenia.

reakcje zachodzące w roztworach wodnych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
W zlewce umieszczono świeżo przygotowany roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI).
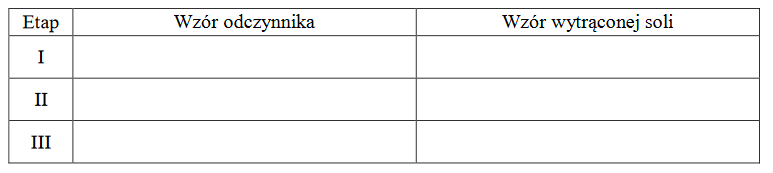
Zaplanuj doświadczenie, które w następujących po sobie etapach I–III umożliwi wydzielenie z opisanego roztworu – przez wytrącenie osadów soli – kolejno wszystkich anionów kwasów tlenowych. Napisz w odpowiedniej kolejności wzory odczynników oraz wzory wytrąconych soli.
Odczynniki: BaCl₂(aq) MgCl₂(aq) CuCl₂(aq)
zasady bilansu elektronowego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
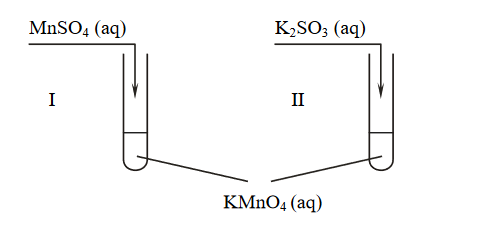
W obu probówkach wytrącił się brunatny osad.
1. Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
2. Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu poreakcji w probówce I:
Nazwa anionu zawierającego siarkę:
reakcje zachodzące w roztworach wodnych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Do probówki ze stałym etanianem (octanem) sodu dodano kwas siarkowy(VI) i zawartość naczynia ogrzano. U wylotu probówki wyczuwalny był charakterystyczny ostry zapach.
1. Napisz, czy użycie do przeprowadzenia opisanego doświadczenia kwasu ortofosforowego(V) zamiast kwasu siarkowego(VI) pozwoli na zaobserwowanie podobnych efektów.
2. W dwóch nieopisanych probówkach znajdują się wodne roztwory dwóch soli (każdy roztwór w innej probówce). Wiadomo, że jednym roztworem jest wodny roztwór etanianu (octanu) magnezu, a drugim – wodny roztwór etanianu (octanu) sodu.
Oceń, czy po dodaniu wodnego roztworu kwasu ortofosforowego(V) do obu probówek i ogrzaniu ich zawartości możliwe będzie wskazanie, w której probówce znajdował się wodny roztwór etanianu magnezu, a w której – wodny roztwór etanianu sodu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie: