Dwuujemny jon pierwiastka.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma konfigurację elektronową
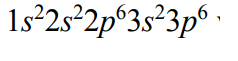
w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16.
Cząsteczka tego związku ma budowę liniową.
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań
typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego.
Wzór sumaryczny: ………………………………..
Typ hybrydyzacji: ………………………………..
Liczba wiązań typu σ: ……………………………
Liczba wiązań typu π: …………………………..
Diagram fazowy tlenku węgla(IV).
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Poniższy diagram fazowy tlenku węgla(IV) przedstawia wartości temperatury i ciśnienia, w których CO2 występuje w różnych fazach: w stanie stałym, ciekłym lub gazowym. Linie ciągłe określają warunki temperatury i ciśnienia, w których istnieje trwała równowaga między
dwiema fazami. W punkcie oznaczonym symbolem P3 (T = 216 K i p = 5100 hPa) CO2 występuje w trzech fazach znajdujących się w stanie równowagi.
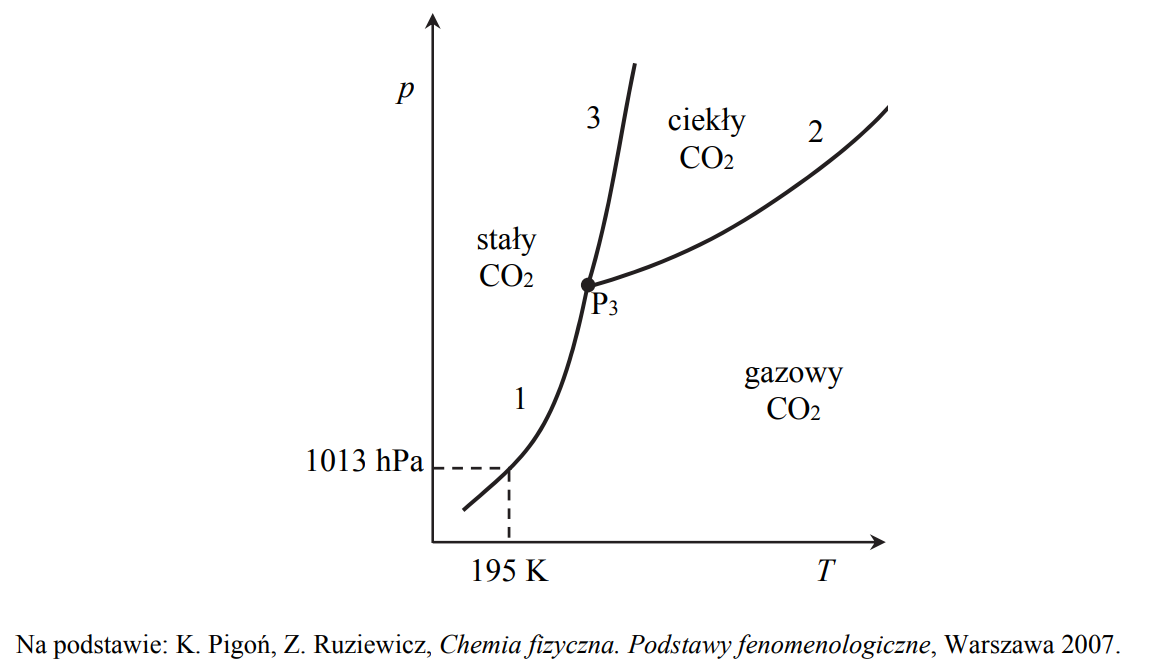
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Reakcja rozpadu promieniotwórczego radonu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Radon jest pierwiastkiem promieniotwórczym, którego najbardziej rozpowszechniony izotop to W przyrodzie powstaje on bezpośrednio z rozpadu 226Ra. Okres półtrwania 222Rn jest równy 3,8 dnia, a inne izotopy tego pierwiastka są jeszcze mniej trwałe, więc wykazuje
on dużą aktywność promieniotwórczą.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Zawartość radonu w powietrzu pobranym z kopalni wynosi 4·10^13 atomów w 1 m3.
Oblicz, po jakim czasie zawartość radonu zmaleje do 5·10^12 atomów w 1 m3.
Napisz równanie reakcji powstawania 222Rn z 226Ra. Uzupełnij wszystkie pola w poniższym schemacie.
Reakcja anionu tlenkowego z cząsteczką wody.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Reakcja anionu tlenkowego z wodą.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Aniony tlenkowe w sieci krystalicznej.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastków mających (małą / dużą) elektroujemność i należących do grup układu okresowego o numerach: (1 i 2 / 14 i 15 / 16 i 17). Ulegające reakcji z wodą tlenki tych pierwiastków
tworzą roztwory o silnie (kwasowym / zasadowym) odczynie, a więc o (niskim / wysokim) pH.
Badanie właściwości pierwiastka.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Badano zachowanie pewnego tlenku Z wobec wody (probówki I i II) oraz wobec wodnego roztworu wodorotlenku sodu w podwyższonej temperaturze (probówka III). Przebieg doświadczenia zilustrowano schematem:
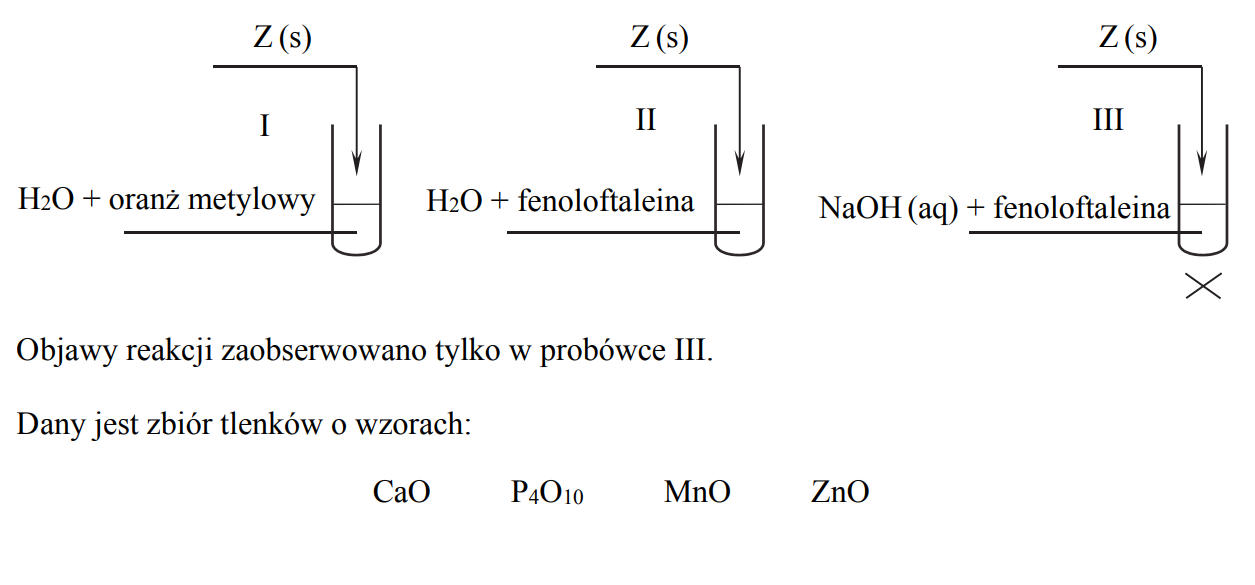
Spośród wymienionych tlenków wybierz ten, który mógł być użyty do wykonania opisanego doświadczenia. Uzupełnij tabelę. Wpisz wzór wybranego tlenku i określ jego charakter chemiczny (kwasowy, zasadowy, amfoteryczny).

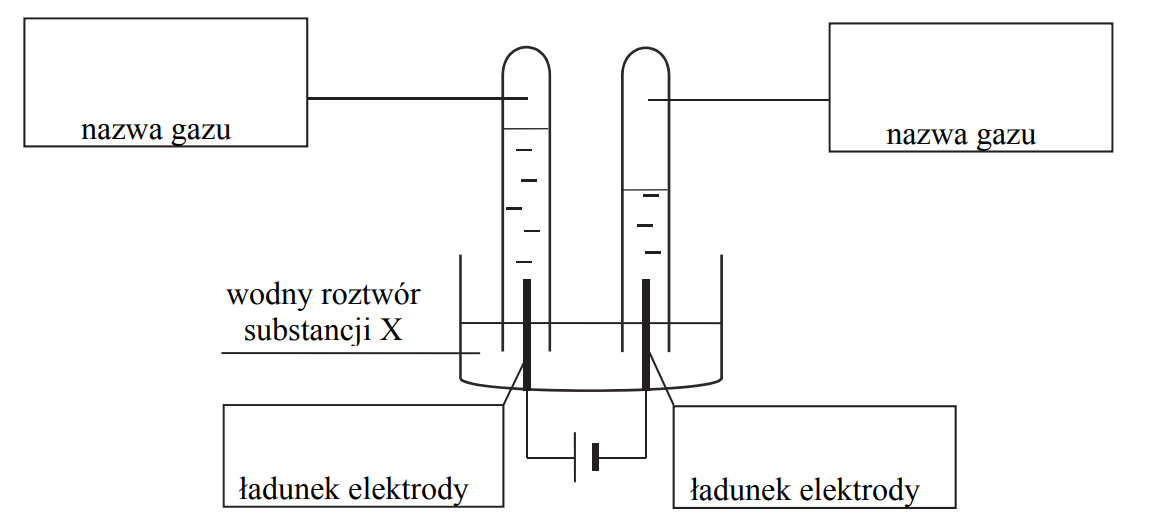
Elektroliza roztworu chlorowodoru.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Elektroliza wodnego roztworu HCl przebiega zgodnie z równaniem:
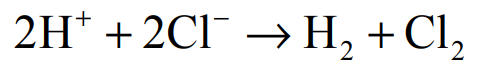
Podczas elektrolizy przez wodny roztwór HCl o objętości 400,0 cm3
i o stężeniu 0,1 mol·dm−3 przepłynął ładunek 3821,4 C.
Wykonaj odpowiednie obliczenia i określ, jak się zmieniło (wzrosło czy zmalało), i o ile jednostek, pH tego roztworu w wyniku elektrolizy. Podczas rozwiązywania zadania nie zaokrąglaj wyników pośrednich. Stała Faradaya ma wartość F = 96500 C · mol–1. Przyjmij, że objętość roztworu nie uległa zmianie, a podczas elektrolizy nie zachodziły procesy uboczne, np. rozkład wody.
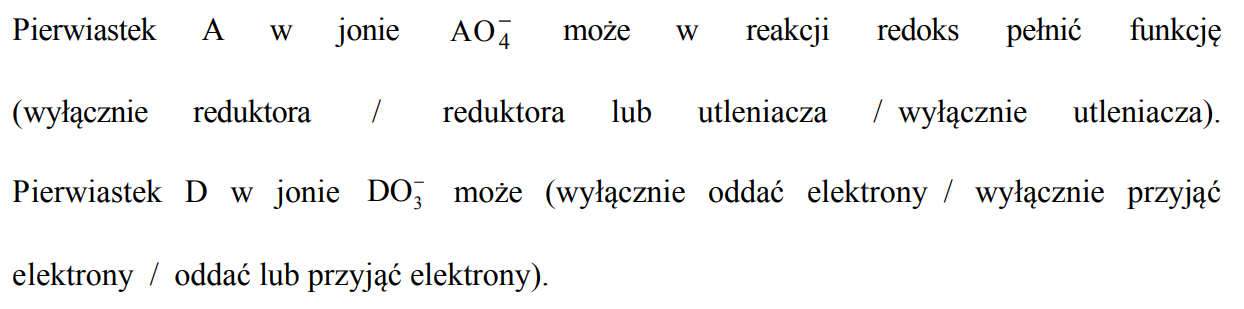
Reduktory i utleniacze.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Ze zbioru:
Fe
Ni
Co
Hg
Mn2+
Cd2+
Cu2+
Ag+
wybierz drobiny, które spełniają warunki opisane w poniższej tabeli. Symbole i wzory wybranych drobin wpisz w wyznaczone miejsca.

Reakcje cynku z kwasem solnym i octowym.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Przeprowadzono doświadczenie, w którym do probówki I wlano kwas solny o pH = 2, a do probówki II – wodny roztwór kwasu octowego (etanowego) o pH = 2. Roztwory miały temperaturę 298 K. Następnie do obu probówek dodano po 1 gramie pyłu
cynkowego. Opisane doświadczenie zilustrowano poniższym schematem.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Papierek wskaźnikowy, barwy w kwasie octowym i roztworze zasady sodowej.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwór zawierający 0,1 mola kwasu etanowego (octowego). Następnie w mieszaninie poreakcyjnej
zanurzono żółty uniwersalny papierek wskaźnikowy.
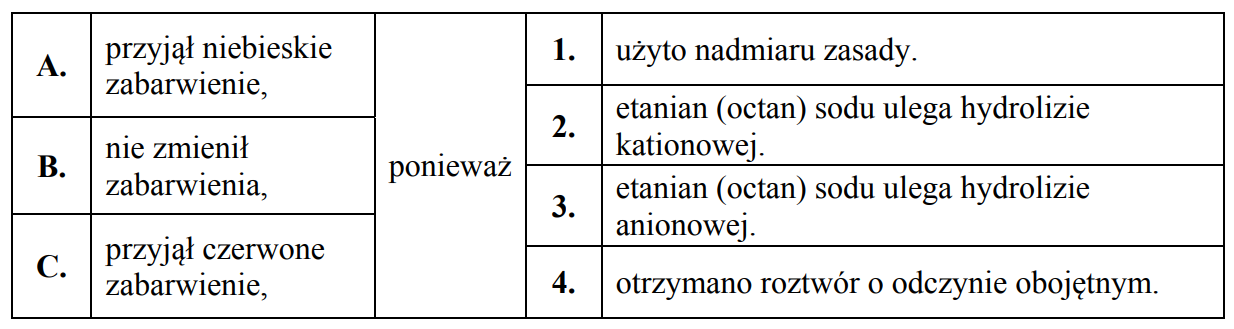
Dokończ poniższe zdanie. Wybierz i zaznacz odpowiedź A, B albo C i jej uzasadnienie 1., 2., 3. albo 4.
Uniwersalny papierek wskaźnikowy
Obliczanie masy molowej substancji.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Masowy stosunek stechiometryczny substratów reakcji
2A + B → C + 3D
wynosi mA : mB = 4 : 7. W reakcji zużyto 45 g substancji B i stechiometryczną ilość substancji A. W wyniku reakcji, przebiegającej z wydajnością równą 100%, otrzymano 13 dm3 gazowego produktu C (objętość zmierzono w warunkach normalnych). Masa molowa substancji C jest równa 26 g·mol−1.
Oblicz masę molową substancji D.
Wpływ na szybkość reakcji oraz na stałą równowagi.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Tlenek azotu(II) można otrzymać w łuku elektrycznym w wyniku endotermicznej reakcji odwracalnej zilustrowanej poniższym równaniem.
N2 (g) + O2 (g) ⇄ 2NO (g)
Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej.
zmaleje
wzrośnie
nie ulegnie zmianie
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost temperatury, to wartość stałej równowagi opisanej reakcji ………………………………………… .
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost ciśnienia (T=const), to wydajność opisanej reakcji ………………………………………… .
Jeśli do układu będącego w stanie równowagi wprowadzi się katalizator, to ilość NO w układzie ………………………………………… .
Jeśli z układu będącego w stanie równowagi usunie się część azotu, to ilość tlenu w układzie ………………………………………… .