Dwa pierwiastki oznaczono umownie literami X i Z.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma
konfigurację elektronową 1s2 2s2 2p6 3s2 3p6 w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16. Cząsteczka tego związku ma budowę liniową.
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego.
Wzór sumaryczny: ……………………………….. Typ hybrydyzacji: ………………………………..
Liczba wiązań typu σ: …………………………… Liczba wiązań typu π: …………………………..
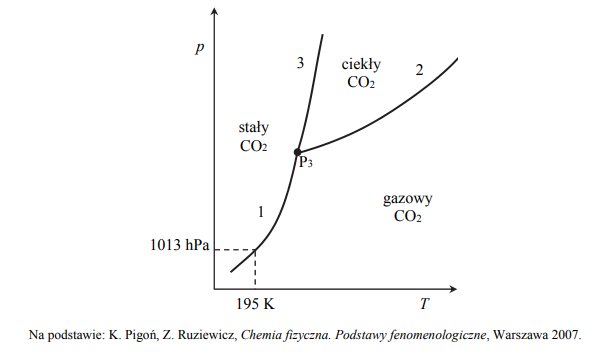
Diagram fazowy tlenku węgla(IV)
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Poniższy diagram fazowy tlenku węgla(IV) przedstawia wartości temperatury i ciśnienia,
w których CO2 występuje w różnych fazach: w stanie stałym, ciekłym lub gazowym. Linie
ciągłe określają warunki temperatury i ciśnienia, w których istnieje trwała równowaga między dwiema fazami. W punkcie oznaczonym symbolem P3 (T = 216 K i p = 5100 hPa) CO2 występuje w trzech fazach znajdujących się w stanie równowagi.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

W kryształach metalicznych sieć krystaliczna zbudowana jest…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Uzupełnij poniższe zdania dotyczące czterech różnych rodzajów kryształów. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
W kryształach metalicznych sieć krystaliczna zbudowana jest z (atomów /
cząsteczek / kationów i anionów / kationów metali) otoczonych chmurą zdelokalizowanych elektronów. Elementami, z których zbudowana jest sieć krystaliczna tlenku wapnia, są (atomy / cząsteczki / kationy i aniony). W kryształach molekularnych dominują oddziaływania międzycząsteczkowe, a w kryształach kowalencyjnych atomy tworzące sieć krystaliczną połączone są wiązaniami kowalencyjnymi. Przykładem kryształu molekularnego jest kryształ (chlorku sodu / sacharozy / wapnia), a przykładem kryształu kowalencyjnego – kryształ (diamentu / jodu / węglanu wapnia).
Równanie reakcji anionu tlenkowego z cząsteczką wody.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon
tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastkówmających…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon
tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastków
mających (małą / dużą) elektroujemność i należących do grup układu okresowego
o numerach: (1 i 2 / 14 i 15 / 16 i 17). Ulegające reakcji z wodą tlenki tych pierwiastków
tworzą roztwory o silnie (kwasowym / zasadowym) odczynie, a więc o (niskim / wysokim)
pH.
W przemyśle wodór można otrzymać w procesie konwersji metanu…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W przemyśle wodór można otrzymać w procesie konwersji metanu będącego głównym
składnikiem gazu ziemnego. W mieszaninie gazu ziemnego i pary wodnej w pewnej
temperaturze T i w obecności katalizatora niklowego zachodzą m.in. reakcje opisane
poniższymi równaniami.
I CH4 (g) + H2O (g) ⇄ CO (g) + 3H2 (g)
II CH4 (g) + 2H2O (g) ⇄ CO2 (g) + 4H2 (g)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna zmieszane
w stosunku masowym 1 : 1, a sumaryczna liczba moli tych reagentów była równa 20.
Stężeniowa stała równowagi reakcji
CO (g) + H2O (g) ⇄ CO2 (g) + H2 (g)
w warunkach prowadzenia procesu wynosi 1.
Oblicz, ile moli wodoru znajdowało się w reaktorze po osiągnięciu stanu równowagi przez układ.
W zamkniętym reaktorze o pojemności 1 dm3 znajdowały się gazowe substancje A i B…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W zamkniętym reaktorze o pojemności 1 dm3 znajdowały się gazowe substancje A i B
zmieszane w stosunku stechiometrycznym. Reagenty ogrzano do temperatury T i zainicjowano reakcję przebiegającą zgodnie z poniższym schematem.
A (g) + 2B(g) ⇄ 3C(g) + D (g)
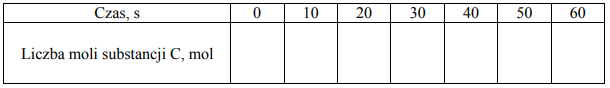
Przez jedną minutę, co 10 sekund, oznaczano liczbę moli substancji A
w mieszaninie reakcyjnej. Wyniki zestawiono w poniższej tabeli.
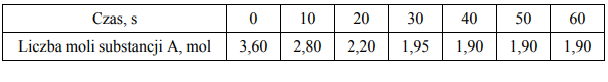
Uzupełnij poniższą tabelę, a następnie narysuj wykres przedstawiający zależność stężenia substancji C od czasu trwania reakcji, czyli w przedziale <0s, 60s> .
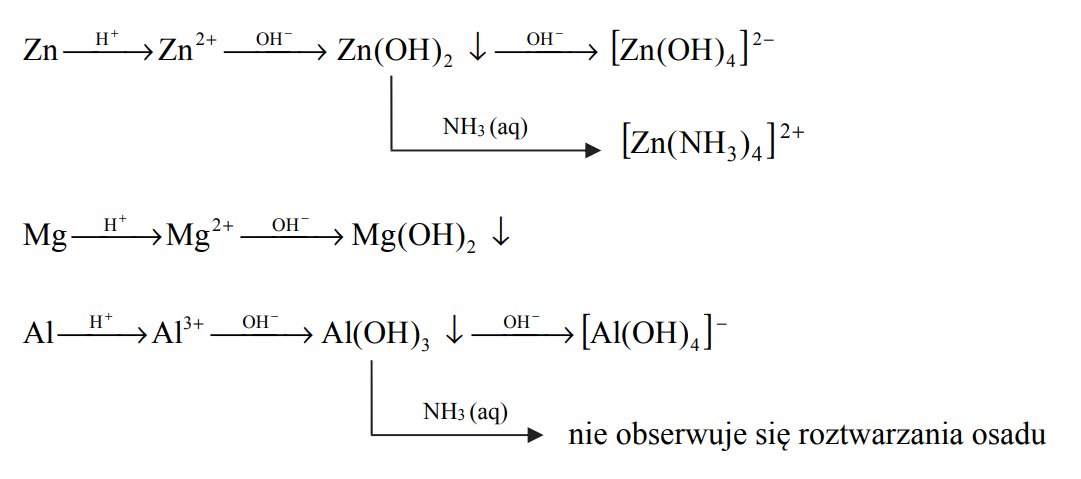
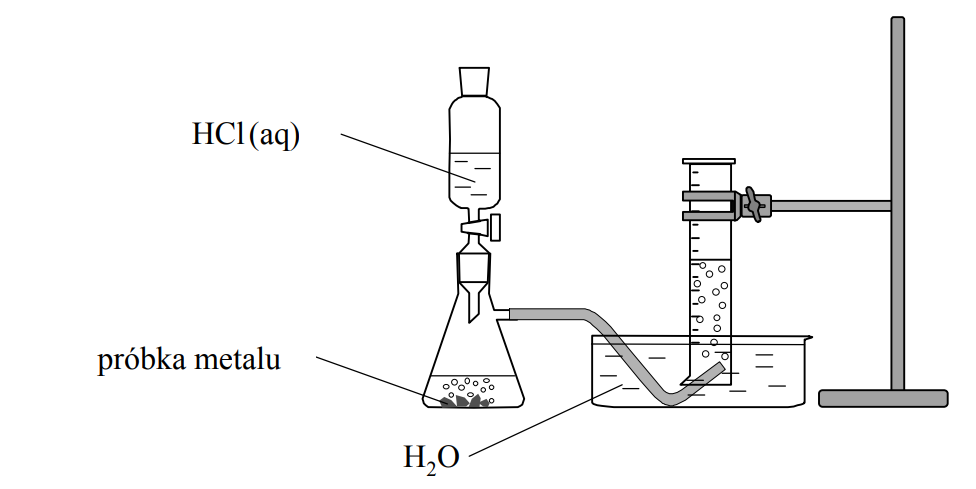
W kolbach oznaczonych numerami I, II i III umieszczono w przypadkowej kolejności próbki cynku, magnezu i glinu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Cynk, magnez i glin w opisanych poniżej doświadczeniach ulegają przemianom zilustrowanym następującymi schematami:
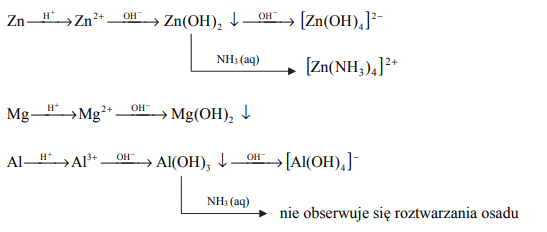
W kolbach oznaczonych numerami I, II i III umieszczono w przypadkowej kolejności próbki cynku, magnezu i glinu. W każdej kolbie była próbka innego metalu. Na te metale podziałano kwasem solnym. Opisane doświadczenie zilustrowano poniższym schematem.
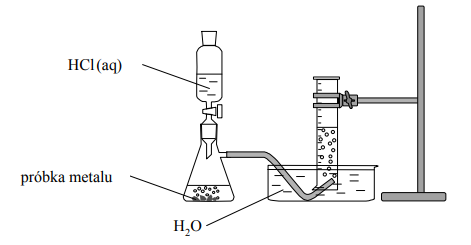
Podczas opisanego doświadczenia w każdej kolbie metal uległ całkowitemu roztworzeniu
i powstały klarowne, bezbarwne roztwory chlorków badanych metali. Przebiegowi wszystkich
reakcji towarzyszyło wydzielanie się bezbarwnego gazu.
Spośród czynności, których nazwy podano poniżej, wybierz tę, którą należy wykonać jako pierwszą w celu wyodrębnienia z każdej mieszaniny poreakcyjnej (powstałej podczas opisanego doświadczenia) jonowego produktu reakcji. Podkreśl jej nazwę.
Napisz w formie jonowej skróconej równanie reakcji glinu z kwasem solnym.
……………………………………………………………………………………………………………………………………
Oblicz stopień dysocjacji kwasu HX w tym roztworze.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX+H2O ⇄ + − H3O + X
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).
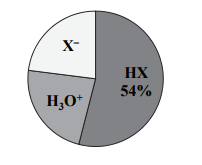
Oblicz stopień dysocjacji kwasu HX w tym roztworze.
Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX+H2O ⇄ + − H3O + X
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).

Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu.
Temperatura roztworu nie uległa zmianie.
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stopnia dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stałej dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
Oblicz objętość kwasu solnego o stężeniu 0,1 mol·dm−3…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Reakcja kwasu solnego z wodorotlenkiem potasu przebiega zgodnie z równaniem
HCl + KOH → KCl + H2O
Oblicz objętość kwasu solnego o stężeniu 0,1 mol·dm−3, jaką należy dodać do 300 cm3 wodnego roztworu wodorotlenku potasu o stężeniu 0,2 mol·dm−3, aby otrzymany roztwór miał pH = 13. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodniez równaniem:
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie
z równaniem:
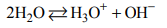
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona
równaniem:
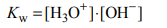
Poniżej przedstawiono wartości iloczynu jonowego wody Kw w zakresie temperatury
0 ºC–100 ºC (pod ciśnieniem atmosferycznym).

Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Reakcja autodysocjacji wody jest (egzoenergetyczna / endoenergetyczna). Wraz ze wzrostem temperatury pH czystej wody (maleje / rośnie / nie ulega zmianie).
Zdolność autoprotolizy charakteryzuje nie tylko wodę..
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie
z równaniem:
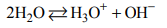
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona
równaniem:
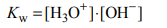
Zdolność autoprotolizy charakteryzuje nie tylko wodę, lecz także inne rozpuszczalniki, np.: ciekły amoniak (skroplony pod zwiększonym ciśnieniem), metanol i kwas mrówkowy.
Napisz trzy równania reakcji autoprotolizy: ciekłego amoniaku, metanolu i kwasu
mrówkowego. Zastosuj wzory półstrukturalne (grupowe) organicznych produktów
reakcji.

Wyjaśnij, dlaczego cząsteczki amoniaku, metanolu i kwasu mrówkowego mają zdolność odszczepiania i przyłączania protonu w procesie autoprotolizy. Odnieś się do budowy tych cząsteczek.
Cząsteczki wymienionych związków mają zdolność odszczepiania protonu, ponieważ:
Cząsteczki wymienionych związków mają zdolność przyłączania protonu, ponieważ: