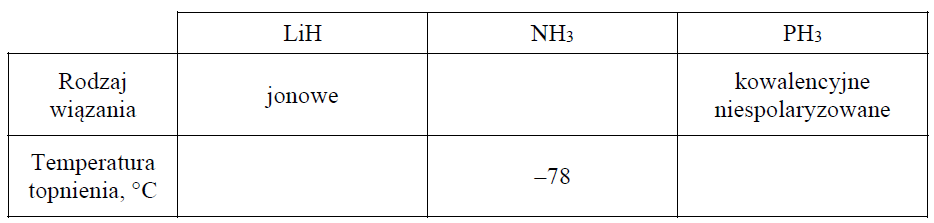
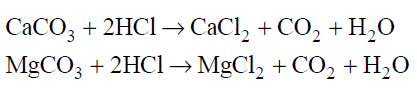Temperatury topnienia amoniaku, wodorku litu i wodorku fosforu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Ustal i wpisz do tabeli, jaki rodzaj wiązania (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) występuje w cząsteczce NH3. Następnie przyporządkuj dwóm związkom: LiH i PH3, wartości ich temperatury topnienia: 692 °C, –134 °C (pod ciśnieniem 1013 hPa).
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Ustalanie stałej równowagi dla reakcji tlenku węgla(II) z wodą
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Stężeniowa stała równowagi reakcji
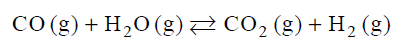
w temperaturze 1000 K jest równa 1.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W reaktorze o stałej pojemności znajdowało się 6 moli tlenku węgla(II).
Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora, aby po ustaleniu się równowagi w temperaturze 1000 K liczba moli wodoru była dwa razy większa od liczby moli tlenku węgla(II).
Marmur, wapno palone, wapno gaszone, gips krystaliczny, krzemionka.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
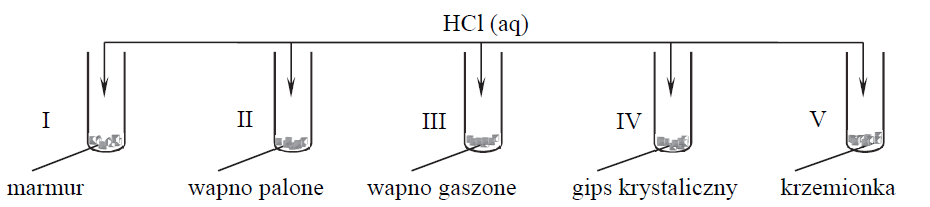
Napisz numery wszystkich probówek, w których zaszły reakcje chemiczne.
Identyfikacja kationów metali.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm 3 i jednakowe stężenie molowe cm = 0,2 mol · dm−3 . W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie.
W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.
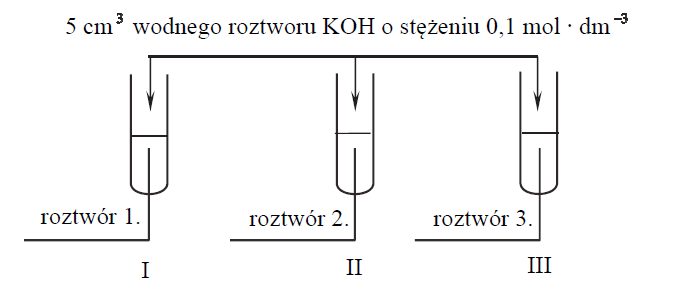
Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu powstały w probówkach I i II białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II.
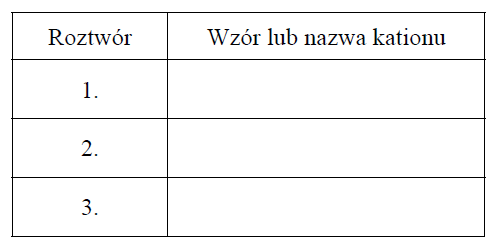
Zidentyfikuj kationy obecne w roztworach 1., 2. i 3. Wpisz ich wzory lub nazwy do tabeli.
Roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm 3 i jednakowe stężenie molowe cm = 0,2 mol · dm−3 . W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie.
W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.

Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu powstały w probówkach I i II białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas pierwszego etapu doświadczenia w probówce I.
Powstawanie anionu kompleksowego w środowisku zasadowym.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm 3 i jednakowe stężenie molowe cm = 0,2 mol · dm−3 . W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie.
W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.

Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu powstały w probówkach I i II białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce II podczas drugiego etapu doświadczenia, jeżeli w tym procesie powstaje anion kompleksowy.
pH roztworu po częściowym zobojętnianiu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Przygotowano dwa wodne roztwory:
– kwasu siarkowego(VI) o stężeniu 0,01 mol · dm−3 (roztwór I)
– wodorotlenku sodu o pH równym 13 (roztwór II) do którego dodano kilka kropli alkoholowego roztworu fenoloftaleiny.
Podczas mieszania roztworów I i II zachodzi reakcja opisana poniższym równaniem:
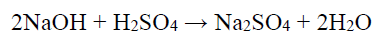
Do kolby zawierającej 100 cm 3 roztworu I dodawano niewielkimi porcjami roztwór II.
Oblicz pH roztworu, który powstał po dodaniu 50 cm 3 roztworu II do roztworu I. Przyjmij, że objętość powstałego roztworu jest sumą objętości roztworu I i dodanego roztworu II.
Reakcja zobojętniania zasady sodowej.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Przygotowano dwa wodne roztwory:
– kwasu siarkowego(VI) o stężeniu 0,01 mol · dm−3 (roztwór I)
– wodorotlenku sodu o pH równym 13 (roztwór II) do którego dodano kilka kropli alkoholowego roztworu fenoloftaleiny.
Podczas mieszania roztworów I i II zachodzi reakcja opisana poniższym równaniem:
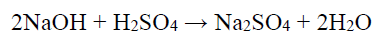
Uzupełnij zdanie. Wybierz i zaznacz odpowiedź A. albo B. oraz jej uzasadnienie 1., 2., 3. albo 4.
Jeżeli do 100 cm 3 roztworu I dodamy 10 cm 3 roztworu II, to otrzymana mieszanina
Barwy kationów metali.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
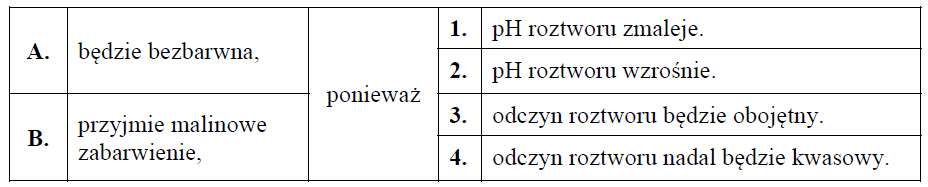
W poniższej tabeli podana jest informacja dotycząca barwy wodnych roztworów zawierających wybrane jony.
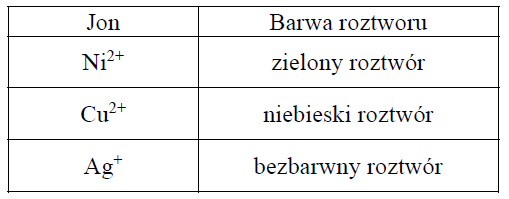
Płytki wykonane z dwóch metali: miedzi i niklu, zanurzono do roztworów azotanu(V) srebra(I) znajdujących się w dwóch oddzielnych probówkach. Przebieg doświadczenia zilustrowano na poniższym schemacie.
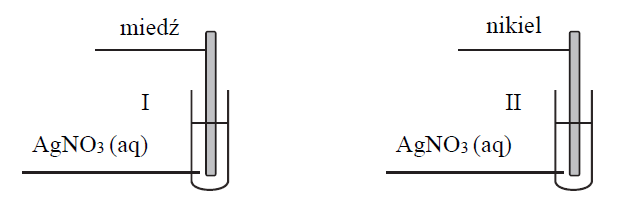
Po pewnym czasie trwania doświadczenia w każdej probówce zaobserwowano zmianę barwy roztworu.
Uzupełnij poniższą tabelę. Podaj barwę roztworu (lub informację o braku barwy) w probówkach I i II przed zanurzeniem metalowych płytek oraz barwy roztworów po wyjęciu płytek.

Który z kationów jest najsilniejszym utleniaczem?
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
W poniższej tabeli podana jest informacja dotycząca barwy wodnych roztworów zawierających wybrane jony.

Płytki wykonane z dwóch metali: miedzi i niklu, zanurzono do roztworów azotanu(V) srebra(I) znajdujących się w dwóch oddzielnych probówkach. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Po pewnym czasie trwania doświadczenia w każdej probówce zaobserwowano zmianę barwy roztworu.
Spośród kationów: Ag+, Cu2+, Ni2+, wybierz i napisz wzór tego kationu, który jest najsilniejszym utleniaczem.
Wydajność przemiany chlorku sodu z kwasem siarkowym(VI)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Próbkę stałego chlorku sodu o masie 7,5 g poddano działaniu stężonego kwasu siarkowego(VI). Zaszła wówczas reakcja opisana równaniem:
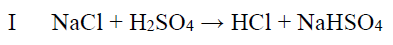
Tę reakcję prowadzono aż do całkowitego zużycia chlorku sodu. Otrzymany w tej reakcji chlorowodór zebrano, rozpuszczono w wodzie i poddano działaniu tlenku manganu(IV),
w wyniku czego zaszła reakcja zgodnie z równaniem:
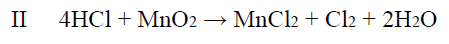
Powstały w tej przemianie chlor wprowadzono do wodnego roztworu jodku potasu i otrzymano 6,35 grama jodu zgodnie z równaniem:
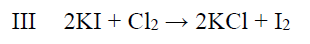
Oblicz wydajność przemiany II, jeżeli przemiany I i III zaszły z wydajnością równą 100%.
Zachowanie ołowiu względem kwasu jodowodorowego i bromowodorowego.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Ołów praktycznie nie roztwarza się w rozcieńczonym kwasie jodowodorowym ani w rozcieńczonym kwasie bromowodorowym. Metal ten roztwarza się natomiast całkowicie w rozcieńczonym kwasie azotowym(V), a także w kwasie octowym. W reakcji ołowiu z rozcieńczonym kwasem azotowym(V) powstają azotan(V) ołowiu(II), tlenek azotu(II) oraz woda. W reakcji tego metalu z kwasem octowym wydziela się wodór i powstaje kompleks ołowiu(II) o wzorze
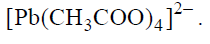
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Na podstawie informacji wprowadzającej, szeregu elektrochemicznego metali oraz tabeli rozpuszczalności soli i wodorotlenków wybierz poprawne wyjaśnienie zachowania ołowiu wobec rozcieńczonego kwasu jodowodorowego i kwasu bromowodorowego. Zaznacz P przy poprawnym wyjaśnieniu.

Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy):
• równanie procesu redukcji zachodzącego podczas reakcji ołowiu z rozcieńczonym kwasem azotowym(V).
• równanie procesu utleniania w reakcji ołowiu z kwasem octowym. Uwzględnij powstawanie jonu kompleksowego tego metalu.