Reakcja złota z wodą królewską.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Złoto jest doskonale kowalnym żółtym metalem o silnym połysku. W czystej postaci jest
stosunkowo miękkie, więc w wyrobach jubilerskich stosuje się stopy złota z innymi metalami,
np. srebrem lub miedzią. Zawartość czystego złota w tych wyrobach podaje się w jednostkach
zwanych karatami. Jeden karat odpowiada 1/24 zawartości masowej złota w stopie, co oznacza,
że czyste złoto jest 24-karatowe. Złoto jest metalem szlachetnym, więc trudno ulega reakcjom
chemicznym. Roztwarza się w wodzie królewskiej, przy czym powstaje m.in. chlorkowy
kompleks złota(III), co ilustruje poniższe równanie:

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest
prawdziwa, albo F – jeśli jest fałszywa.

Przeliczanie karatów złota.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Złoto jest doskonale kowalnym żółtym metalem o silnym połysku. W czystej postaci jest
stosunkowo miękkie, więc w wyrobach jubilerskich stosuje się stopy złota z innymi metalami,
np. srebrem lub miedzią. Zawartość czystego złota w tych wyrobach podaje się w jednostkach
zwanych karatami. Jeden karat odpowiada 1/24 zawartości masowej złota w stopie, co oznacza,
że czyste złoto jest 24-karatowe. Złoto jest metalem szlachetnym, więc trudno ulega reakcjom
chemicznym. Roztwarza się w wodzie królewskiej, przy czym powstaje m.in. chlorkowy
kompleks złota(III), co ilustruje poniższe równanie:

Oblicz, ile gramów czystego złota należy stopić z 10 gramami 15-karatowego złota, aby
otrzymać złoto 18-karatowe.

Substratem do otrzymywania pirytu jest kwas siarkowy (VI)
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W jednej z przemysłowych metod otrzymywania kwasu siarkowego(VI) jako substrat
pierwszego etapu stosuje się piryt (FeS2) – powszechnie występujący minerał.

W wyniku opisanego procesu – do którego na pierwszym etapie wykorzystano
100 gramów pirytu niezawierającego zanieczyszczeń – otrzymano wodny roztwór kwasu
siarkowego (VI) o stężeniu 96% masowych. Sumaryczna wydajność procesu była równa 85%.
Oblicz masę wodnego roztworu kwasu siarkowego(VI) uzyskanego w opisanym procesie.

Różnice w przebiegu doświadczenia z udziałem siarczanu(IV) sodu i azotanu(V) sodu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że wodny roztwór
siarczanu(IV) sodu wprowadzono do probówki I, a wodny roztwór azotanu(V) sodu
– do probówki II.
Uzupełnij schemat doświadczenia: podkreśl nazwę odczynnika, który – po dodaniu do
niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi
zaobserwowanie różnic w przebiegu doświadczenia z udziałem siarczanu(IV) sodu
i azotanu(V) sodu.

Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia (lub zaznacz brak
zmian), pozwalające na potwierdzenie, że do probówki I wprowadzono roztwór
siarczanu(IV) sodu, a do probówki II – roztwór azotanu(V) sodu.
Probówka I:
Probówka II:
Schemat ogniwa galwaicznego. Obliczanie SEM.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Zbudowano ogniwo według schematu przedstawionego na poniższym rysunku.
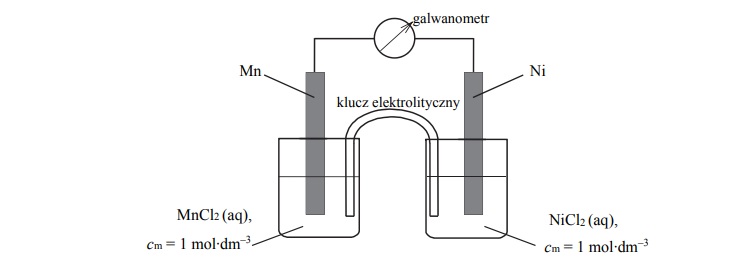
Oblicz siłę elektromotoryczną (SEM), w warunkach standardowych, ogniwa, którego
schemat przedstawiono na rysunku.
SEM =

Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w czasie
pracy tego ogniwa.
Podczas elektrolizy wodnego roztworu chlorku chromu(III) CrCl3…
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Podczas elektrolizy wodnego roztworu chlorku chromu(III) CrCl3 (prowadzonej przy użyciu
elektrod grafitowych) przez roztwór przepłynął ładunek elektryczny Q, co skutkowało
wydzieleniem 156 gramów chromu.
Oblicz, ile gramów cynku wydzieli się podczas przepływu takiego samego ładunku Q przez
roztwór chlorku cynku ZnCl2. Przyjmij, że opisane procesy zachodzą ze 100%
wydajnością. Stała Faradaya ma wartość F = 96500 C mol .

Chloroetan (chlorek etylu) można otrzymać w reakcji addycji lub w reakcji substytucji.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Chloroetan (chlorek etylu) można otrzymać w reakcji addycji lub w reakcji substytucji.
Do zapoczątkowania jednej z opisanych reakcji konieczna jest np. obecność światła. W obu
tych przemianach substratem organicznym jest węglowodór – inny w każdej z przemian.
O węglowodorach tych wiadomo, że należą do dwóch różnych szeregów homologicznych.
Na podstawie: P. Mastalerz, Chemia organiczna, Warszawa 1986.
Zapisz równania opisanych reakcji, z uwzględnieniem faktu, że jedna z nich zachodzi
w obecności światła. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Reakcja addycji:
Reakcja substytucji:
Określ, według jakiego mechanizmu (elektrofilowego, nukleofilowego, rodnikowego)
przebiegają opisane reakcje addycji i substytucji, w wyniku których można otrzymać
chloroetan. Uzupełnij tabelę.

Izomery konstytucyjne. Chiralność
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Cząsteczki jednego z izomerów konstytucyjnych o wzorze C4H9Cl są chiralne.
Narysuj wzór półstrukturalny (grupowy) tego izomeru.

Reakcje spalania węglowodorów. Reakcje całkowitego spalaniametanu oraz dowolnego alkanu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Do całkowitego spalenia 2,80 dm3
(odmierzonych w warunkach normalnych) mieszaniny
zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu
potrzeba 13,16 dm3
tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania
metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
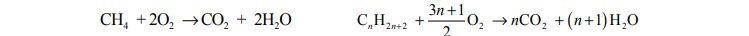
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu, stanowiącego 60%
objętości opisanej mieszaniny.

Przemiany węglowodorów.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Poniżej przedstawiono ciąg przemian chemicznych:
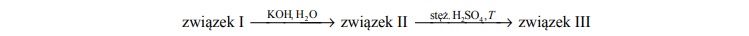
O związkach organicznych I, II i III wiadomo, że:
• związek I jest monobromopochodną alkanu
• związek II jest alkoholem trzeciorzędowym
• w cząsteczce związku III są cztery atomy węgla i osiem atomów wodoru.
Zidentyfikuj związki I, II i III i napisz ich wzory półstrukturalne (grupowe).

Równanie reakcji katalitycznego uwodornienia nitrobenzenu…
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Poniżej przedstawiono ciągi przemian, w wyniku których otrzymano anilinę oraz etanol.
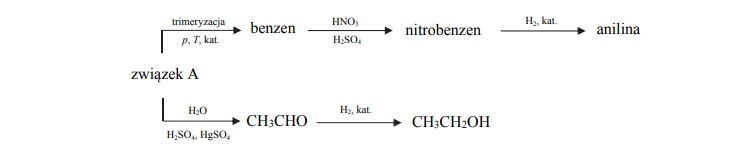
Napisz, stosując wzory półstrukturalne (grupowe) lub uproszczone wzory związków
organicznych, równanie reakcji katalitycznego uwodornienia nitrobenzenu oraz
równanie reakcji, w wyniku której ze związku A powstaje aldehyd
Równanie reakcji katalitycznego uwodornienia nitrobenzenu:
Równanie reakcji, w wyniku której ze związku A powstaje aldehyd:
Otrzymywanie etanolu i aniliny.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Poniżej przedstawiono ciągi przemian, w wyniku których otrzymano anilinę oraz etanol.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest
prawdziwa, albo F – jeśli jest fałszywa.

Wpływ podstawnika na aktywność pierścienia aromatycznego. Nitrobenzen.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Podstawnik już obecny w pierścieniu aromatycznym wywiera wpływ na miejsce wprowadzenia
do niego kolejnego podstawnika w reakcjach elektrofilowych. Grupy alkilowe, –Cl, –Br, –NH2,
–OH kierują kolejny podstawnik w pozycje orto- i para- w stosunku do własnego położenia.
Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny
podstawnik jest wprowadzany głównie w pozycję meta-.
Na lekcji chemii uczniowie projektowali ciąg przemian chemicznych opisany poniższym
schematem.

Uczeń I zaproponował, aby najpierw przeprowadzić reakcję benzenu z chlorem (stosunek
molowy reagentów 1 : 1) w obecności FeCl3 jako katalizatora, a następnie na otrzymany
produkt podziałać mieszaniną nitrującą.
Uczeń II stwierdził, że należy najpierw przeprowadzić reakcję benzenu z mieszaniną nitrującą
i otrzymać mononitropochodną, a dopiero później na otrzymany produkt podziałać chlorem
(stosunek molowy reagentów 1 : 1) w obecności FeCl3 jako katalizatora.
Oceń projekty doświadczeń obu uczniów i wskaż ucznia (I albo II), który błędnie
zaprojektował doświadczenie. Uzasadnij swoje stanowisko.
Błędnie zaprojektował doświadczenie uczeń
Uzasadnienie:
Stałe dysocjacji kwasów organicznych i nieorganicznych.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W poniższej tabeli podane są wartości stałej dysocjacji wybranych związków w temperaturze T.
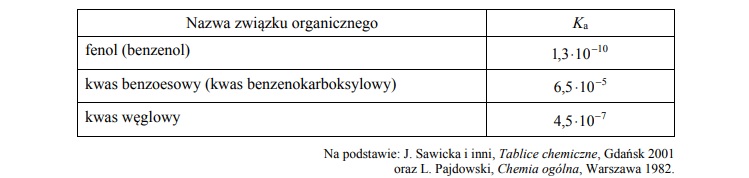
W dwóch nieoznakowanych probówkach znajdują się oddzielnie wodne roztwory kwasu
benzoesowego i fenolu.
Wyjaśnij, dlaczego możliwe jest odróżnienie wodnego roztworu kwasu benzoesowego
od wodnego roztworu fenolu przy użyciu stałego Na2CO3.
Napisz w formie cząsteczkowej równanie reakcji, która jest podstawą eksperymentu.
Przemiany i właściwośći kwasu akrylowego.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Kwas akrylowy jest związkiem o wzorze
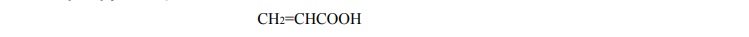
W warunkach laboratoryjnych jest on cieczą.
Przeprowadzono doświadczenie z udziałem kwasu akrylowego zgodnie z poniższym
schematem:
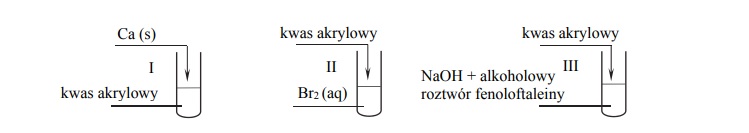
Opisz możliwe do zaobserwowania objawy reakcji w każdej probówce, jeżeli w każdej z przemian kwas akrylowy był reagentem użytym w nadmiarze.
Probówka I:
Probówka II:
Probówka III: