Pierwiastki X i Z leżą w czwartym okresie układu okresowego.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem,
natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków
tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany
elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron
atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO
oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek
Z występuje w postaci dwuatomowych cząsteczek.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich
położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy
każdy z pierwiastków.

Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony
zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
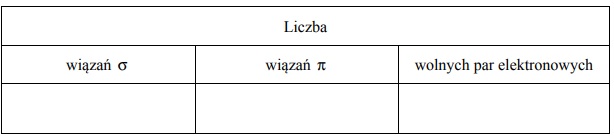
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Jądra atomowe niektórych izotopów ciężkich pierwiastków bombardowane neutronami ulegająrozszczepieniu…
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Jądra atomowe niektórych izotopów ciężkich pierwiastków bombardowane neutronami ulegają
rozszczepieniu, czyli rozpadowi na mniejsze fragmenty. Jedną z możliwych reakcji
rozszczepienia jądra 235 U przedstawia poniższy schemat.
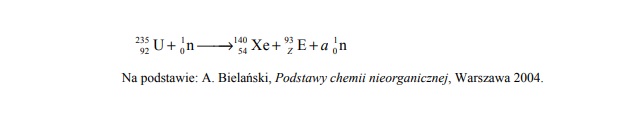
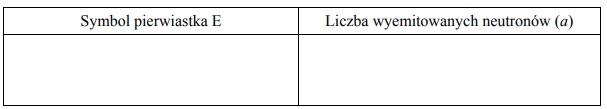
Uzupełnij poniższą tabelę. Na podstawie informacji wstępnej wpisz symbol pierwiastka E
oraz liczbę neutronów (a), wyemitowanych podczas przedstawionej reakcji rozszczepienia
jednego jądra
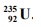
W poniżej tabeli przedstawiono wartości kolejnych (trzech) energii jonizacji glinu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Elektrony w atomach są przyciągane przez jądro, więc usunięcie elektronu z powłoki wymaga
nakładu energii, która jest nazywana energią jonizacji. Pierwsza energia jonizacji to minimalna
energia potrzebna do oderwania pierwszego elektronu od atomu. Druga energia jonizacji jest
minimalną energią potrzebną do usunięcia drugiego elektronu (z jednododatniego jonu).
W odpowiednich warunkach od atomu można oderwać kolejne elektrony. Rozróżnia się zatem
pierwszą, drugą i kolejne energie jonizacji.
W poniżej tabeli przedstawiono wartości kolejnych (trzech) energii jonizacji glinu.

Uzupełnij poniższe zdanie, tak aby powstała informacja prawdziwa, i wyjaśnij, dlaczego
wybrana energia jonizacji ma najniższą wartość.
Spośród podanych wartości energii jonizacji najniższą wartość ma
(pierwsza / druga / trzecia) energia jonizacji, ponieważ
Promień atomu, kationu i anionu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Na podstawie położenia w układzie okresowym następujących pierwiastków: Na, K, Cs,
Mg ustal i napisz symbol tego, który:
• ma największy promień jonowy (promień kationu)
• wykazuje największą aktywność chemiczną
• tworzy tlenek o najsłabszych właściwościach zasadowych.
Pary kwas-zasada. Teoria Bronsteda.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Dane są wzory sześciu cząsteczek i jonów:
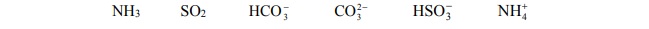
Spośród wymienionych powyżej wzorów wybierz i wpisz do tabeli wzory tych drobin,
które zgodnie z teorią Brønsteda stanowią sprzężone pary kwas–zasada.

Właściwości chemiczne berylu, reakcje berylu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej
przedstawiono schemat reakcji berylu z kwasem i zasadą.
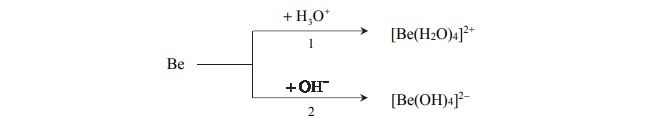
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2,
wiedząc, że jednym z produktów obu przemian jest ten sam gaz. Uwzględnij tworzenie się
kompleksowych jonów berylu.
Równanie reakcji 1:
Równanie reakcji 2:
Rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu. Hydrat. Sól uwodniona.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W temperaturze 20 °C rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze
NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 °C stanowi masa soli
bezwodnej NaHSO4.

Wpływ ciśnienia i temperatury w warunkach izotemricznych i izobarycznych.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Na poniższym wykresie zilustrowano zmianę energii potencjalnej podczas reakcji opisanej
równaniem
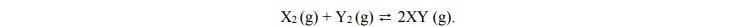
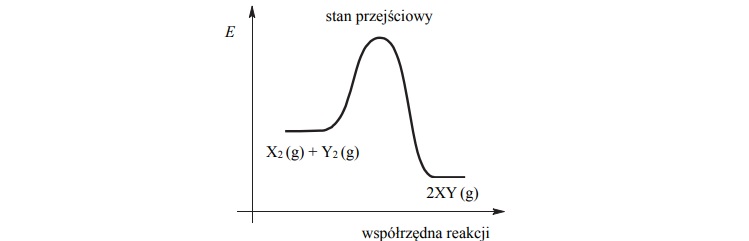
Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie wydajność
reakcji otrzymywania produktu XY, jeżeli w układzie będącym w stanie równowagi
nastąpi
• wzrost temperatury w warunkach izobarycznych (p = const)
• wzrost ciśnienia w warunkach izotermicznych (T = const).
Produktem spalania sodu w tlenie jest nadtlenek tego metalu o wzorze Na2O2
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Produktem spalania sodu w tlenie jest nadtlenek tego metalu o wzorze Na2O2 (reakcja 1.).
Do wody z dodatkiem kilku kropli fenoloftaleiny wprowadzono nadtlenek sodu. Przebiegła
gwałtowna reakcja, w wyniku której powstał m.in. nadtlenek wodoru, a roztwór zabarwił się
na malinowo (reakcja 2.). Następnie do otrzymanej mieszaniny dodano wodny roztwór kwasu
siarkowego(VI), czego skutkiem stało się odbarwienie roztworu (reakcja 3.). Otrzymany
roztwór ogrzano, co doprowadziło do wydzielenia bezbarwnego i bezwonnego gazu, który
podtrzymuje palenie (reakcja 4.).
Napisz w formie cząsteczkowej równania czterech opisanych przemian.
Równanie reakcji 1.:
Równanie reakcji 2.:
Równanie reakcji 3.:
Równanie reakcji 4.:
Obliczanie pH roztworu. Reakcja zobojętniania.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Do 10 cm3
kwasu solnego o pH = 1 dodano 20 cm3
wodnego roztworu wodorotlenku sodu
o stężeniu 0,2 3 mol dm− ⋅ . Przebiegła wtedy reakcja opisana równaniem
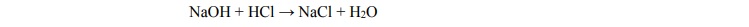
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego
roztworu jest sumą objętości roztworów wyjściowych.

Określanie odczynu roztworu. Reakcja kwasu octwowego z zasadą sodową.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Przeprowadzono doświadczenie zilustrowane na poniższym schemacie.
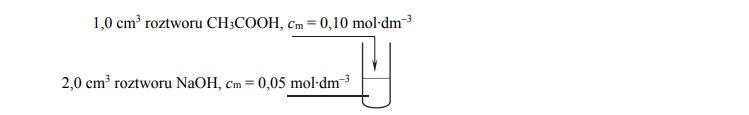
Określ odczyn otrzymanego roztworu. Zapisz w formie jonowej skróconej równanie
reakcji, którym potwierdzisz wskazany odczyn.
Odczyn roztworu:
Równanie reakcji:
Określenie zawartości probówki zawierającej wodny roztwór NH4Cl
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
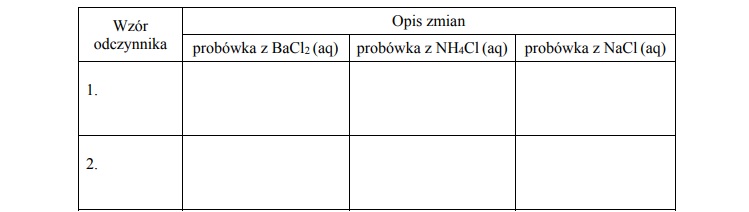
W trzech nieopisanych probówkach znajdują się wodne roztwory następujących soli: BaCl2,
NH4Cl oraz NaCl. W każdej probówce znajduje się roztwór tylko jednej soli.
Z poniższej listy wybierz dwa odczynniki, których zastosowanie pozwoli jednoznacznie
określić zawartość każdej probówki.
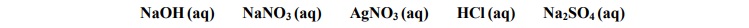
Wypełnij poniższą tabelę – wpisz wzory wybranych odczynników oraz opisz zmiany
możliwe do zaobserwowania (lub zaznacz brak zmian), zachodzące po dodaniu
wybranych odczynników do probówek z wodnymi roztworami soli.
Napisz w formie jonowej skróconej równanie reakcji, która pozwoliła na jednoznaczne
określenie zawartości probówki zawierającej wodny roztwór NH4Cl.
Charakter chemiczny wodorotlenku niklu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.

Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu
wodorotlenku sodu.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku
niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy,
obojętny, amfoteryczny) wodorotlenku niklu(II).
Równanie reakcji:
Charakter chemiczny wodorotlenku niklu(II):
Reakcje procesu utleniania i redukcji soli niklu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.

Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu
przebiega w środowisku wodnym zgodnie ze schematem:
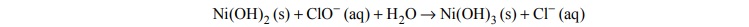
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych
elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania
zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza
w tej reakcji.
Równanie procesu redukcji:
Równanie procesu utleniania:
Stosunek molowy n reduktora : n utleniacza =
Wodorotlenek niklu oraz sole niklu. Zmiany barw.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór
wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu, zgodnie ze
schematem:
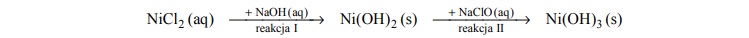
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po
reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.
