Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
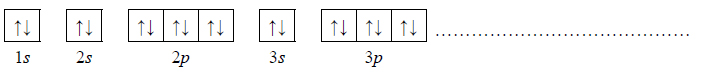
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.
Konfiguracja elektronowa
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła

Wpisz do tabeli symbole chemiczne pierwiastków opisanych niżej.
Konfiguracje elektronowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Atomy pewnego pierwiastka oznaczonego umownie symbolem X mają w stanie podstawowym następującą konfigurację elektronową:
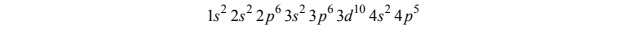

Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Powłoki elektronowe atomu germanu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Na podstawie: W. Kołos, Elementy chemii kwantowej sposobem niematematycznym wyłożone, Warszawa 1984.
Atom germanu w stanie podstawowym ma dwa sparowane elektrony walencyjne
w podpowłoce 4s i dwa niesparowane elektrony walencyjne w podpowłoce 4p.
Oceń, czy możliwe jest obsadzenie elektronami podpowłok 4s i 4p w atomie germanu w sposób przedstawiony poniżej. Odpowiedź uzasadnij.

Zmiany elektroujemności w skali Paulinga pierwiastków.
Arkusz maturalny z chemii rozszerzonej czerwiec 2018 nowa formuła
Na poniższym diagramie przedstawiono zmiany elektroujemności w skali Paulinga
pierwiastków grup 1.–2. oraz 13.–17. układu okresowego (wartości elektroujemności
poszczególnych pierwiastków danej grupy połączono linią ciągłą)
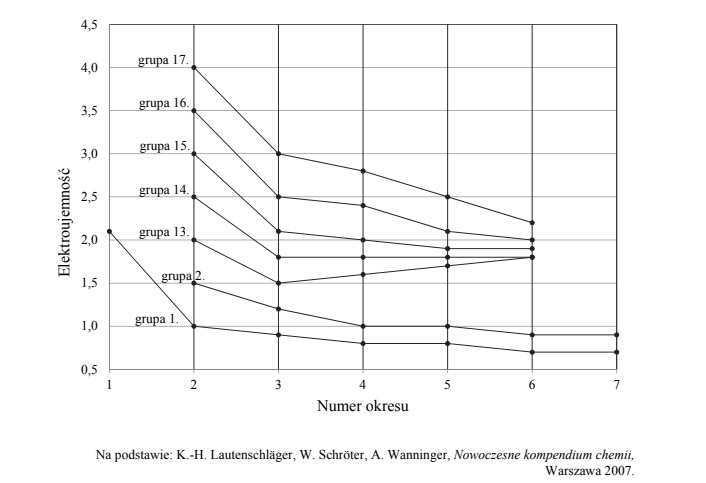

Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Budowa cząsteczki trichlorku fosforu. Charakter wiązania.
Arkusz maturalny z chemii rozszerzonej czerwiec 2018 nowa formuła
Cząsteczka trichlorku fosforu o wzorze PCl3 ma budowę przestrzenną podobną do struktury cząsteczki amoniaku.
Określ charakter wiązania chemicznego (wiązanie kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane) w cząsteczce trichlorku fosforu i napisz wzór elektronowy tej cząsteczki. Zaznacz kreskami wiążące i wolne pary elektronowe.

Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
Orbitalom walencyjnym atomu centralnego w cząsteczce trichlorku fosforu przypisuje się
hybrydyzację typu (sp / sp2/ sp3). Atom centralny (nie stanowi bieguna elektrycznego /
stanowi biegun elektryczny dodatni / stanowi biegun elektryczny ujemny) w tej cząsteczce.
Właściwości chlorku wapnia, etanolu, kwasu etanowego, kwasu solnego i zasady potasowej.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Poniżej podano wzory pięciu rozpuszczalnych w wodzie związków chemicznych.


Wypełnij tabelę – wpisz numery, którymi oznaczono wzory wszystkich związków wykazujących podane w tabeli właściwości.
Reakcje redukcji tlenku azotu wodorem.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
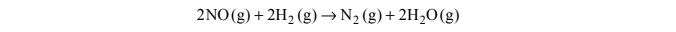
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:
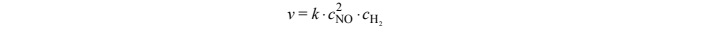
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, c NO i H2 c oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna. Podstawy fenomenologiczne, Warszawa 2007.
W zamkniętym reaktorze o pojemności 2 dm3
zmieszano 6 moli tlenku azotu(II) i 4 mole
wodoru. Podczas reakcji utrzymywano stałą temperaturę.

Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
Reakcja tlenku węgla(II) z parą wodną.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
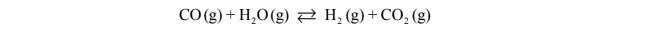
W temperaturze 800 K stężeniowa stała równowagi tej reakcji jest równa 4,0.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
W zamkniętym reaktorze o stałej pojemności zmieszano 1 mol tlenku węgla(II) z parą wodną w ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano
w temperaturze 800 K aż do osiągnięcia stanu równowagi dynamicznej przez układ.

Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Reakcję syntezy tlenku azotu(II).
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcję syntezy tlenku azotu(II) ilustruje równanie:
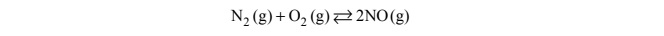
W tabeli podano wartości stężeniowej stałej równowagi Kc reakcji syntezy NO w różnych
temperaturach.
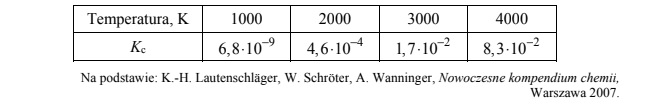
Oceń, czy opisana reakcja jest procesem egzo- czy endotermicznym, oraz spośród poniższych sposobów prowadzenia reakcji wybierz ten powodujący zwiększenie wydajności tworzenia tlenku azotu(II).

Opisana reakcja jest procesem
Numer sposobu zwiększenia wydajności tworzenia tlenku azotu(II):
Stop glinu z magnezem o masie 7.5 g.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Na odważkę stopu glinu z magnezem o masie 7,50 g podziałano nadmiarem rozcieńczonegovkwasu solnego. Podczas roztwarzania stopu w kwasie solnym zachodziły reakcje zilustrowanebrównaniami:

W wyniku całkowitego roztworzenia stopu otrzymano klarowny roztwór, do którego dodano nadmiar wodnego roztworu wodorotlenku sodu. Zaszły reakcje opisane równaniami:
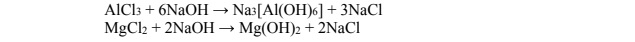
Otrzymany nierozpuszczalny w wodzie związek odsączono, przemyto wodą, wysuszono
i zważono. Jego masa (w przeliczeniu na czysty wodorotlenek magnezu) była równa 11,67 g.
Oblicz zawartość procentową glinu w stopie (w procentach masowych).

Klarowny roztwór uzyskany po odsączeniu osadu Mg(OH)2 nasycono tlenkiem węgla(IV).
Zaobserwowano wytrącenie białego osadu wodorotlenku glinu.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej.
Zmiany pH roztworów po dodaniu różnych związków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Przeprowadzono doświadczenie, w którym do czterech ponumerowanych zlewek I–IV
zawierających po 100 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 3 0,1 mol dm− ⋅ dodano wodne roztwory różnych substancji i wodę destylowaną zgodnie z poniższym rysunkiem.
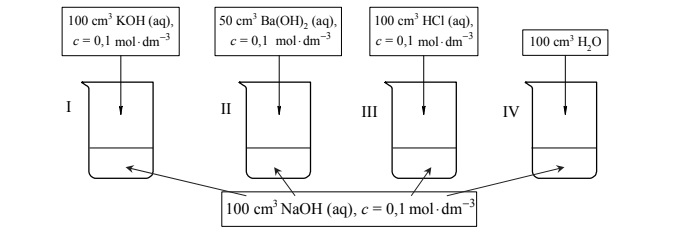

Uzupełnij poniższą tabelę – podaj wartość pH wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol · dm–3 oraz wpisz numery zlewek, w których pH otrzymanego roztworu było niższe albo było wyższe od pH roztworu wyjściowego, albo nie uległo zmianie w czasie doświadczenia.
Roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI)
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
W zlewce umieszczono świeżo przygotowany roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI).
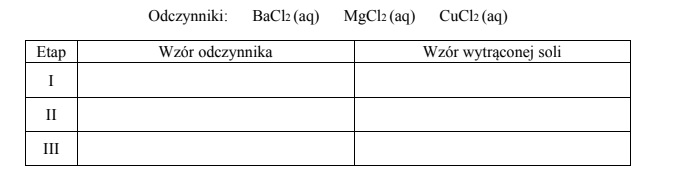
Zaplanuj doświadczenie, które w następujących po sobie etapach I–III umożliwi wydzielenie z opisanego roztworu – przez wytrącenie osadów soli – kolejno wszystkich anionów kwasów tlenowych. Napisz w odpowiedniej kolejności wzory odczynników oraz wzory wytrąconych soli.
Równania procesu redukcji i procesu utleniania. Siarczan (VI) manganu (II), siarczan (IV) potasu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
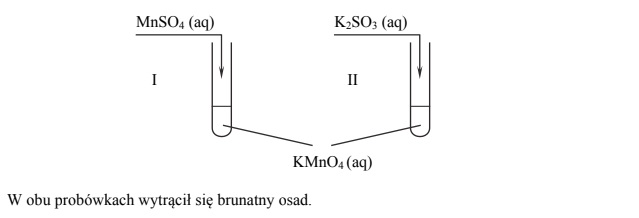
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu po reakcji w probówce I:
Nazwa anionu zawierającego siarkę: