Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
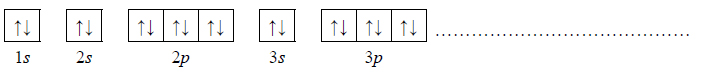
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.