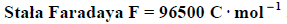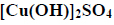Rozkład termiczny węglanu wapnia.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W wysokiej temperaturze (900–1000 °C) węglan wapnia ulega rozkładowi, którego przebieg opisuje równanie:
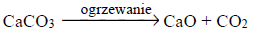
Próbkę węglanu wapnia o masie 10,00 gramów prażono przez pewien czas w otwartym naczyniu. Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowało się 6,04 grama substancji stałych.
Oblicz, jaki procent początkowej masy węglanu wapnia nie uległ rozkładowi.
Reakcja tlenku żelaza (III) z tlenkiem węgla (II)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.
Obliczanie stałej stężeniowej reakcji.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W zamkniętym naczyniu pomiędzy substancjami X, Y oraz Z, które w temperaturze T i pod ciśnieniem p są gazami, ustala się stan równowagi chemicznej.
Zmianę liczby moli reagentów X, Y oraz Z w trakcie procesu przedstawia poniższy wykres.
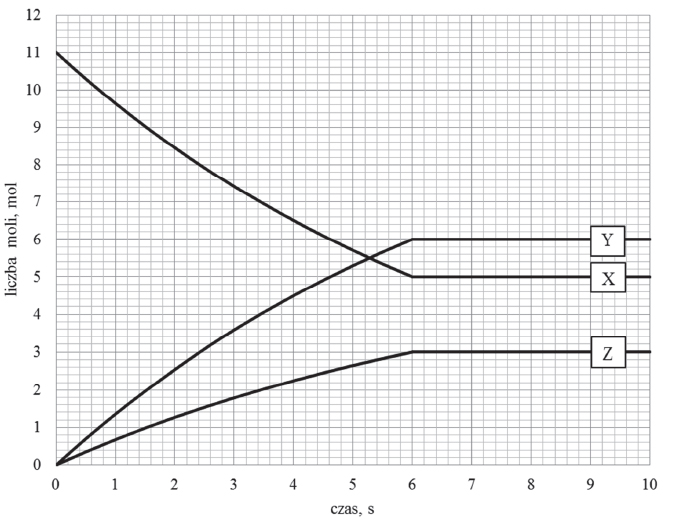
Reakcja, dla której zmianę liczby moli reagentów przedstawiono na wykresie, przebiegała w reaktorze o pojemności 4 dm3. W temperaturze T i pod ciśnieniem p do reaktora wprowadzono substrat reakcji X i badano zmiany liczby moli reagentów w trakcie trwania procesu prowadzącego do ustalenia stanu równowagi dynamicznej.
Oblicz stężeniową stałą równowagi Kc opisanego procesu w temperaturze T.
Blaszka miedziana zanurzona w roztworze srebra.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Blaszkę miedzianą o masie 4,0 g zanurzono w nasyconym wodnym roztworze azotanu(V) srebra. Przebiegała reakcja opisana równaniem:
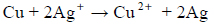
Po pewnym czasie płytkę wyjęto i osuszono. Masa płytki wynosiła 4,3 g.
Oblicz masę srebra osadzonego na płytce.
Elektroliza wodnego roztworu siarczanu (VI) potasu
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Przez 161 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) potasu prądem stałym o natężeniu 1,49 ampera. Zastosowano elektrody platynowe. Stwierdzono, że podczas elektrolizy zaszły procesy elektrodowe rozkładu wody.
1. Napisz równanie procesu zachodzącego podczas elektrolizy tej soli na katodzie oraz równanie procesu przebiegającego podczas elektrolizy tej soli na anodzie.
2. Oblicz, ile gramów gazowego produktu wydzieliło się na katodzie podczas tego procesu, jeżeli przebiegał on ze 100% wydajnością prądową.