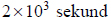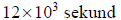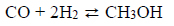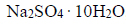Konfiguracja elektronów kationu żelaza.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
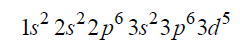

Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
Pierwiastek X tworzy aniony proste…
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Elektrony walencyjne w atomach (w stanie podstawowym) pewnego pierwiastka, którego symbol oznaczono umownie literą X, mają następującą konfigurację:
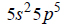
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Określanie położenia w układzie okresowym na podstawie elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Konfiguracja elektronów uczestniczących w tworzeniu wiązań atomu pierwiastka Z jest następująca:
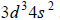
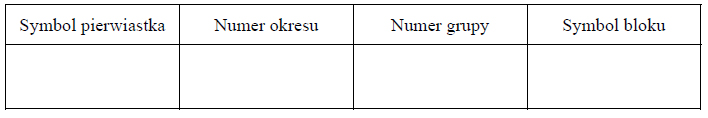
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka Z, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy ten pierwiastek.
Tworzenie wiązań wodorowych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Spośród substancji, których wzory przedstawiono poniżej, wybierz wszystkie, w których między cząsteczkami danej substancji mogą się tworzyć wiązania wodorowe. Wybrane wzory podkreśl.
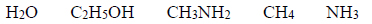
Udział wiązania jonowego w charakterze całego wiązania.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Miarą polaryzacji wiązania jest udział jonowego charakteru w tym wiązaniu: procentowy udział jonowego charakteru w wiązaniu =
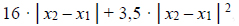
gdzie x1 i x2 oznaczają elektroujemności pierwiastków tworzących wiązanie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W tabeli zapisano informacje dotyczące wiązania jonowego.
Rozstrzygnij, która z nich jest prawdziwa. Zaznacz P przy zdaniu prawdziwym.

Reakcja amoniaku z chlorowodorem.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Gazowy amoniak reaguje z gazowym chlorowodorem zgodnie z równaniem
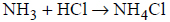
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie.
Produkt reakcji amoniaku i chlorowodoru występuje w warunkach normalnych w (stałym / ciekłym / gazowym) stanie skupienia. Kation amonowy NH4+ powstaje w wyniku
(przyłączenia protonu / oddania protonu) przez cząsteczkę amoniaku. W tym kationie (wszystkie / nie wszystkie) atomy wodoru są równocenne. W reakcji z chlorowodorem amoniak pełni funkcję (kwasu / zasady) Brønsteda.
Hybrydyzacja i budowa przestrzenna metanu, amoniaku i wody.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W cząsteczkach
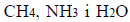
występuje ten sam typ hybrydyzacji orbitali walencyjnych atomu centralnego, ale w każdej z tych cząsteczek wartość kąta pomiędzy wiązaniami jest inna. Wynosi ona około 109° w cząsteczce CH4, około 107° w cząsteczce NH3 i około 105° w cząsteczce H2O.
Określ typ hybrydyzacji (sp, sp2 , sp3 ) orbitali walencyjnych atomu centralnego w cząsteczkach CH4, NH3 i H2O oraz napisz, co jest przyczyną różnicy wartości kąta pomiędzy wiązaniami w tych cząsteczkach.
Przemysłowa produkcja żelaza. Tlenek żelaza (II, III)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
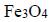
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.
Hydrat tiosiarczanu sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W wyniku reakcji chemicznej roztworu siarczanu(IV) sodu z siarką otrzymuje się wodny roztwór tiosiarczanu sodu. Proces ten można opisać równaniem:
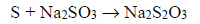
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W wodzie rozpuszczono 6,3 g
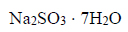
i dodano nadmiar siarki. Otrzymaną mieszaninę gotowano przez pewien czas, po czym przesączono w celu usunięcia nadmiaru siarki. Z przesączu po ochłodzeniu otrzymano 5,2 g kryształów uwodnionego tiosiarczanu sodu. Ten związek, poddany odwodnieniu pod obniżonym ciśnieniem, zmniejszył swoją masę o 36,3%
Wykonaj odpowiednie obliczenia i podaj wzór hydratu tiosiarczanu sodu, który otrzymano z mieszaniny poreakcyjnej w wyniku krystalizacji.
Krystalizacja tiosiarczanu sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W wyniku reakcji chemicznej roztworu siarczanu(IV) sodu z siarką otrzymuje się wodny roztwór tiosiarczanu sodu. Proces ten można opisać równaniem:
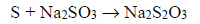
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W wodzie rozpuszczono 6,3 g
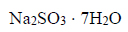
i dodano nadmiar siarki. Otrzymaną mieszaninę gotowano przez pewien czas, po czym przesączono w celu usunięcia nadmiaru siarki. Z przesączu po ochłodzeniu otrzymano 5,2 g kryształów uwodnionego tiosiarczanu sodu. Ten związek, poddany odwodnieniu pod obniżonym ciśnieniem, zmniejszył swoją masę o 36,3%.
Załóż, że synteza tiosiarczanu sodu zachodzi z wydajnością 100%, i oblicz, jaka była wydajność procesu krystalizacji.
Asocjacja cząsteczek fluorowodoru.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Cząsteczki fluorowodoru ulegają asocjacji, czyli łączą się ze sobą, tworząc zygzakowate łańcuchy. W temperaturze bliskiej temperatury wrzenia równej 293,7 K i pod ciśnieniem p = 1013 hPa gęstość par fluorowodoru wynosi
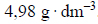
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
1. Oblicz masę molową asocjatu fluorowodoru (HF)n w temperaturze 293,7 K i pod ciśnieniem 1013 hPa oraz ustal liczbę cząsteczek n tworzących ten asocjat. Objętość molowa gazu w tych warunkach temperatury i ciśnienia jest równa
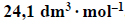
2. Wyjaśnij, dlaczego cząsteczki fluorowodoru ulegają asocjacji.