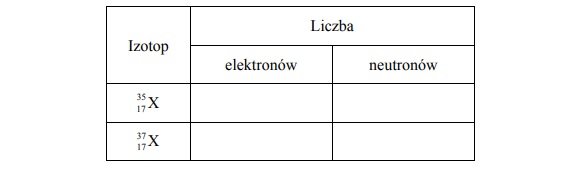
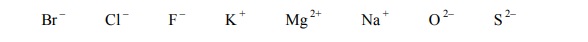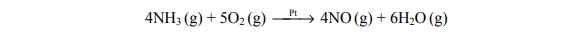Rozpuszczalność bromku potasu w wodzie.
Arkusz maturalny z chemii podstawowej maj 2017
Rozpuszczalność bromku potasu w temperaturze 20 °C jest równa 65 gramów w 100 gramach wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Wykonaj obliczenia i oceń, czy można całkowicie rozpuścić 1 mol bromku potasu w 180 gramach wody w temperaturze 20 °C.

Dysocjacja związków chemicznych.
Arkusz maturalny z chemii podstawowej maj 2017
Spośród związków o wzorach przedstawionych poniżej wybierz wszystkie te, które w wodnych roztworach nie ulegają dysocjacji elektrolitycznej. Podkreśl wzory wybranych związków.
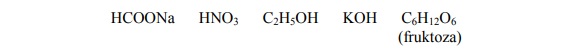
Wykrywanie anionów chlorkowych w roztworze wodnym.
Arkusz maturalny z chemii podstawowej maj 2017
Do probówki wlano 4 cm3 chlorowanej wody wodociągowej. Zaprojektuj doświadczenie, które pozwoli potwierdzić obecność anionów chlorkowych w wodzie wodociągowej.
Korzystając z tabeli rozpuszczalności, wybierz właściwy odczynnik spośród następujących i podkreśl jego nazwę.
− wodny roztwór chlorku sodu
− wodny roztwór azotanu(V) sodu
− wodny roztwór azotanu(V) srebra
Opisz zmiany, które można zaobserwować po dodaniu do badanej wody wybranego odczynnika, potwierdzające obecność anionów chlorkowych.
Napisz w formie jonowej skróconej równanie reakcji, która spowodowała te zmiany.
Stężenie molowe jodku potasu w roztworze.
Arkusz maturalny z chemii podstawowej maj 2017
Rozpuszczono w wodzie 33,2 g jodku potasu (KI), w wyniku czego otrzymano 150 cm3 roztworu.
Oblicz stężenie molowe tego roztworu.

Reakcje w roztworach wodnych.
Arkusz maturalny z chemii podstawowej maj 2017
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
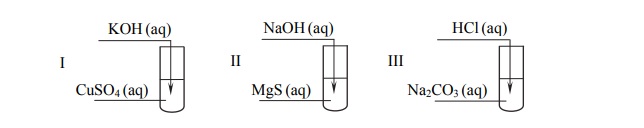
Objawy reakcji zaobserwowano we wszystkich probówkach.
Podaj numer probówki, w której wydzielił się gaz, oraz numer probówki, w której wytrącił się niebieski, galaretowaty osad.
Numer probówki, w której wydzielił się gaz:
Numer probówki, w której wytrącił się niebieski osad:
Napisz w formie jonowej skróconej równanie reakcji przebiegającej w probówce I.
Reakcje wapna palonego i wapna gaszonego.
Arkusz maturalny z chemii podstawowej maj 2017
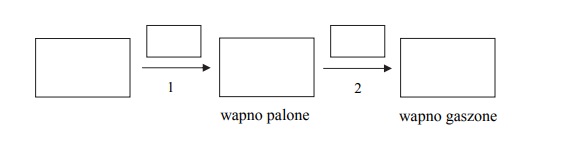
W przemyśle wapno gaszone otrzymuje się w dwuetapowym procesie. Najpierw węglan wapnia poddaje się rozkładowi w temperaturze 1000 o C. W wyniku tego procesu otrzymuje się tlenek zwany wapnem palonym, który w procesie gaszenia przekształca się w wapno gaszone.
Uzupełnij poniższy schemat otrzymywania wapna gaszonego z węglanu wapnia.
W puste (większe) pola wpisz wzory związków chemicznych. W pole umieszczone nad
strzałką oznaczoną numerem 1 wpisz warunki konieczne do przeprowadzenia
przemiany, a w pole nad strzałką oznaczoną numerem 2 wpisz wzór drugiego substratu
przemiany.
Wpływ katalizatora na szybkość reakcji rozkładu nadtlenku wodoru.
Arkusz maturalny z chemii podstawowej maj 2017
Energia aktywacji określa wielkość bariery energetycznej, którą muszą pokonać reagujące
drobiny, aby doszło do reakcji chemicznej. Im mniejsza jest energia aktywacji dla danej
reakcji, tym szybciej zachodzi przemiana. Dużą energię aktywacji reakcji można zmniejszyć,
jeżeli wprowadzi się do układu katalizator.
Nadtlenek wodoru ulega reakcji rozkładu według równania:
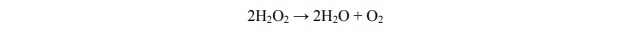
W temperaturze pokojowej szybkość rozkładu H2O2 jest mała. W poniższej tabeli podano
wartości energii aktywacji reakcji rozkładu H2O2 bez udziału katalizatora oraz z udziałem
różnych katalizatorów.

Oceń, którego katalizatora spośród wymienionych w informacji należy użyć, aby
reakcja rozkładu nadtlenku wodoru w temperaturze T przebiegła z największą
szybkością. Napisz nazwę tego katalizatora.
Wpływ katalizatora na energię aktywacji rozkładu nadtlenku wodoru.
Arkusz maturalny z chemii podstawowej maj 2017
Energia aktywacji określa wielkość bariery energetycznej, którą muszą pokonać reagujące
drobiny, aby doszło do reakcji chemicznej. Im mniejsza jest energia aktywacji dla danej
reakcji, tym szybciej zachodzi przemiana. Dużą energię aktywacji reakcji można zmniejszyć,
jeżeli wprowadzi się do układu katalizator.
Nadtlenek wodoru ulega reakcji rozkładu według równania:
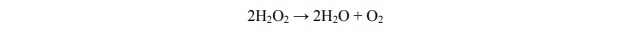
W temperaturze pokojowej szybkość rozkładu H2O2 jest mała. W poniższej tabeli podano
wartości energii aktywacji reakcji rozkładu H2O2 bez udziału katalizatora oraz z udziałem
różnych katalizatorów.

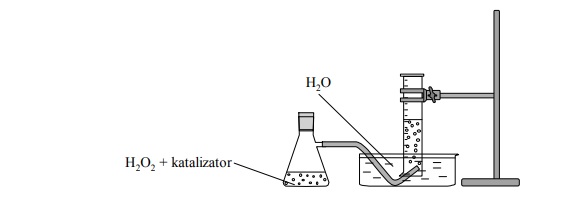
Przeprowadzono doświadczenie zilustrowane poniższym schematem
Uzupełnij poniższe zdania. W każdym nawiasie wybierz i podkreśl właściwe określenie.
Podczas doświadczenia zaobserwowano wydzielanie (barwnego / bezbarwnego) gazu, który
(dobrze / słabo) rozpuszcza się w wodzie. Po umieszczeniu w probówce z zebranym gazem
tlącego się łuczywka zapala się ono jasnym płomieniem, co świadczy o tym, że otrzymany
gaz (jest palny / podtrzymuje palenie).