Rozpad promieniotwórczy jąder izotopu.
Arkusz maturalny z chemii podstawowej maj 2007
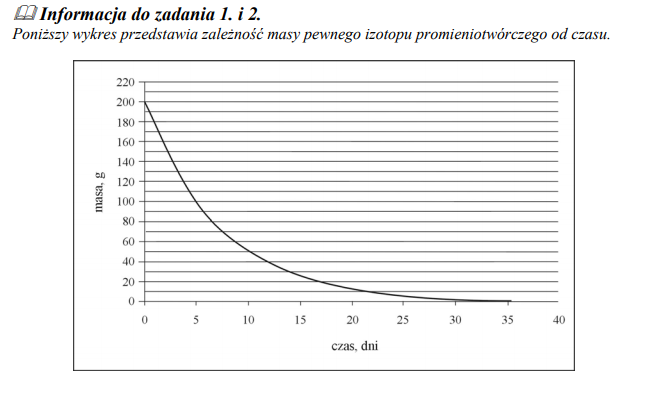
Okres półtrwania to czas, po upływie którego rozpadowi ulega połowa jąder izotopu promieniotwórczego.
Na podstawie zamieszczonego wyżej wykresu oszacuj okres półtrwania tego izotopu.
Zależność masy pewnego izotopu promieniotwórczego od czasu.
Arkusz maturalny z chemii podstawowej maj 2007

Korzystając z powyższego wykresu, oszacuj, ile gramów izotopu pozostało po 15 dniach.
Liczba atomowa oraz masowa pierwiastka
Arkusz maturalny z chemii podstawowej maj 2007
Poniższe równanie ilustruje przebieg przemiany promieniotwórczej, której ulega izotop uranu.
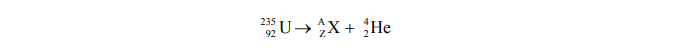
Ustal liczbę atomową, liczbę masową i symbol izotopu X.
Liczba atomowa:
Liczba masowa:
Symbol:
Ustalenie położenie pierwiastka w układzie okresowym
Arkusz maturalny z chemii podstawowej maj 2007
Pierwiastek E tworzy wodorek o wzorze EH4 oraz tlenki EO i EO2. W atomie tego pierwiastka, w stanie podstawowym, elektrony rozmieszczone są na dwóch powłokach.
Ustal położenie pierwiastka E w układzie okresowym oraz podaj jego nazwę.
Numer grupy:
Numer okresu:
Nazwa:
Właściwości pierwiastków, jonów i cząstek elementarnych.
Arkusz maturalny z chemii podstawowej maj 2007
Uzupełnij poniższą tabelę, wpisując w każdym wierszu jeden z symboli wybranych spośród:

Rodzaje wiązań chemicznych w związkach.
Arkusz maturalny z chemii podstawowej maj 2007
Korzystając ze skali elektroujemności wg Paulinga, określ rodzaj wiązania chemicznego w następujących związkach:
RbCl
CO2
PH3
Produkty reakcji magnezu z parą wodną.
Arkusz maturalny z chemii podstawowej maj 2007
Napisz równanie reakcji magnezu z parą wodną. Określ charakter chemiczny produktu reakcji zawierającego magnez.
Równanie reakcji:
Charakter chemiczny:
Reakcja spalania magnezu.
Arkusz maturalny z chemii podstawowej maj 2007
Wskaż prawidłowe zakończenie poniższego zdania. Do gaszenia płonącego magnezu nie należy używać wody, gdyż

Reakcje chemiczne potwierdzające charakter chemiczny tlenku potasu i siarki (IV)
Arkusz maturalny z chemii podstawowej maj 2007
Przedstaw projekt doświadczenia, którego celem jest określenie charakteru chemicznego tlenku potasu i tlenku siarki(VI). W tym celu:
a) uzupełnij poniższy opis doświadczenia, wpisując nazwy potrzebnych odczynników wybranych spośród następujących: woda, oranż metylowy, fenoloftaleina.

b) napisz, jakie obserwacje umożliwią określenie charakteru chemicznego tlenków (uwzględnij zmianę barwy wybranych wskaźników).
I:
II:
c) napisz w formie cząsteczkowej równania zachodzących reakcji.
I:
II:
Reakcja siarczku miedzi w kwasie azotowym(V)
Arkusz maturalny z chemii podstawowej maj 2007
Uzupełnij współczynniki stechiometryczne w podanym równaniu reakcji. Zastosuj metodę bilansu elektronowego.
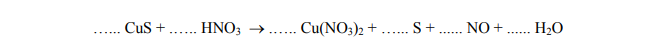
Bilans elektronowy:
Reakcja zobojętniania wody wapiennej.
Arkusz maturalny z chemii podstawowej maj 2007
Przeprowadzono reakcję zobojętniania zilustrowaną równaniem:
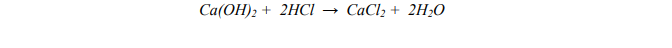
Oblicz, jaką objętość kwasu solnego o stężeniu 0,5 mol/dm3 należy użyć do całkowitego zobojętnienia 100 cm3 roztworu Ca(OH)2 o stężeniu 0,2 mol/dm3.

Wydzielanie trującego gazu.
Arkusz maturalny z chemii podstawowej maj 2007
Przeprowadzono następujące doświadczenia:
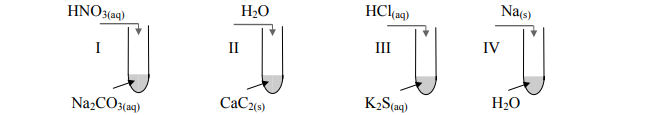
Wskaż numer probówki, w której wydzielił się trujący gaz o charakterystycznym, przykrym zapachu.
A. I
B. II
C. III
D. IV
Kwaśne deszcze, eutrofizacja wód, efekt cieplarniany.
Arkusz maturalny z chemii podstawowej maj 2007
W kolumnie I przedstawiono nazwy wybranych zjawisk, a w kolumnie II nazwy substancji, których nadmiar może być przyczyną występowania tych zjawisk.
Przyporządkuj zjawiskom z kolumny I odpowiednie nazwy substancji z kolumny II.

Reakcje strąceniowe jonów w wodzie mineralnej.
Arkusz maturalny z chemii podstawowej maj 2007
Na etykiecie wody mineralnej podano informację, że zawiera ona między innymi kationy: Na+, K+, Ca2+ oraz aniony: Cl –, SO42–.
W celu potwierdzenia obecności jonów w tej wodzie przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym rysunku. Jako odczynników użyto stężonych roztworów soli. We wszystkich probówkach zaobserwowano powstanie białych osadów.
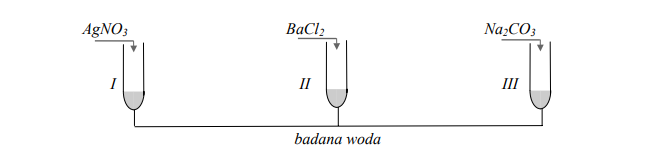
Podaj wzory jonów, których obecność potwierdzono, a następnie napisz w formie jonowej skróconej równania reakcji, jakie przebiegały podczas doświadczenia.
Potwierdzono obecność jonów
I: …
II: …
III: …
Równania reakcji (w formie jonowej skróconej):
I
II
III
Stosunek masowy i molowy kwasu siarkowego(VI) i zasady sodowej w reakcji zobojętniania.
Arkusz maturalny z chemii podstawowej maj 2007
Przeprowadzono reakcję zobojętniania, która przebiegła zgodnie z równaniem:
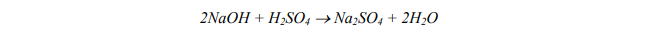
Uzupełnij poniższy zapis, podając, jaki jest stosunek molowy oraz masowy substratów w powyższej reakcji.
Stosunek molowy: n : n =
Stosunek masowy: m : m =