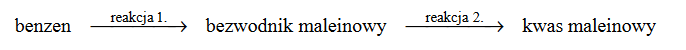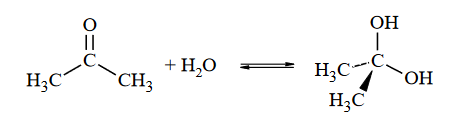reakcja monobromowania alkanów
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Izomeryczne alkany o wzorze C₅H₁₂ , zależnie od budowy, mogą tworzyć jeden lub kilka produktów reakcji monobromowania.
1. Narysuj wzór półstrukturalny (grupowy) i podaj nazwę systematyczną tego izomeru o wzorze C₅H₁₂ , który w reakcji z bromem w obecności światła tworzy tylko jedną
monobromopochodną.
Wzór półstrukturalny:
Nazwa systematyczna:
2. Napisz równanie reakcji monobromowania izomeru o wzorze C₅H₁₂, w którym podstawieniu ulega atom wodoru przy III-rzędowym atomie węgla. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
cykloalkan – węglowodór cykliczny alifatyczny
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Poniżej przedstawiono uproszczone wzory trzech alkenów i jednego węglowodoru cyklicznego alifatycznego (cykloalkanu). W cząsteczkach węglowodorów cyklicznych szkielet węglowy tworzy pierścienie.
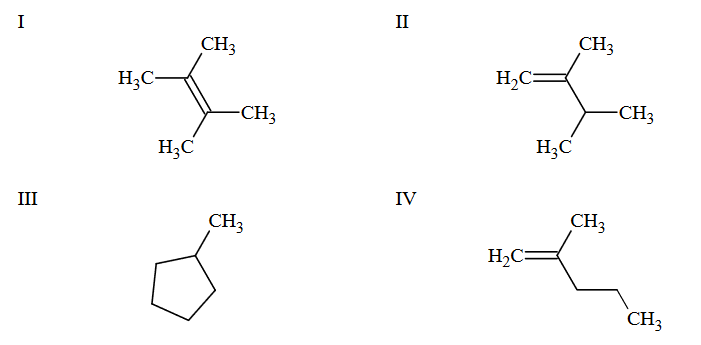
1. Wybierz wszystkie związki, które są izomerami 2,3-dimetylobut-1-enu. Napisz numery, którymi oznaczono ich wzory.
2. Napisz równanie reakcji addycji bromowodoru do związku IV zachodzącej zgodnie z regułą Markownikowa. Zastosuj wzory półstrukturalne (grupowe) związków
organicznych.
3. Podaj nazwę systematyczną związku I.
Identyfikacja związków organicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
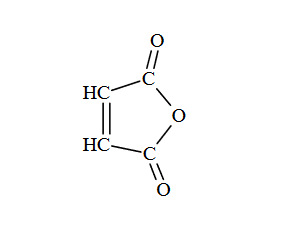
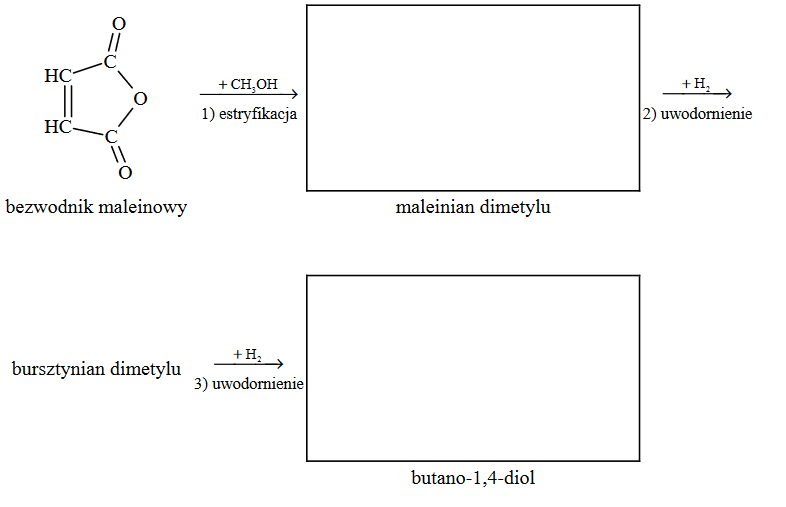
Poniżej przedstawiono schemat przemian wybranych związków organicznych:
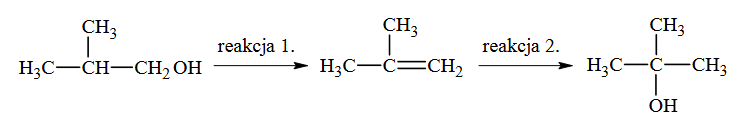
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

reakcja nitrowania toluenu
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie.
Nitrowanie toluenu jest przykładem reakcji (substytucji / addycji / eliminacji) i przebiega według mechanizmu (rodnikowego / elektrofilowego / nukleofilowego). W reakcji stężonego kwasu azotowego(V) ze stężonym kwasem siarkowym(VI) powstaje
(rodnik nitroniowy / anion nitroniowy / kation nitroniowy).
Kontrolowane utlenianie alkanów
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Kontrolowane utlenianie alkanów jest stosowane w przemyśle do wytwarzania kwasów tłuszczowych. W odpowiednich warunkach ta reakcja przebiega selektywnie w taki sposób, że utleniona zostaje tylko jedna ze skrajnych grup metylowych.
Napisz wzór sumaryczny alkanu, który może zostać użyty do otrzymania kwasu stearynowego (oktadekanowego) opisaną metodą.
reakcja redukcji nitrobenzenu wodorem
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W wyniku redukcji nitrobenzenu wodorem otrzymano aromatyczną aminę, która reaguje z kwasem solnym w stosunku molowym 1 : 1 (reakcja 1.) oraz z bromem w stosunku molowym 1 : 3 (reakcja 2.).
Napisz równania reakcji 1. i 2. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Równanie reakcji 1.:
Równanie reakcji 2.:
podstawniki cząsteczek i ich wpływ na kwasowość i zasadowość związków organicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
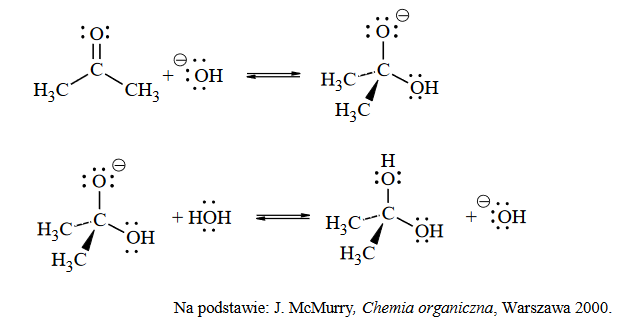
Na kwasowość i zasadowość związków organicznych mają wpływ podstawniki znajdujące się w cząsteczkach w sąsiedztwie grup funkcyjnych. Przykładem takiego wpływu jest efekt indukcyjny, czyli oddziaływanie podstawników polegające na przyciąganiu (–I) lub odpychaniu (+I) elektronów, co prowadzi do zmiany stopnia polaryzacji wiązań w cząsteczce. Ujemny efekt indukcyjny (–I) skutkuje wzrostem mocy kwasów i obniżeniem mocy zasad.
Przeciwnie działa dodatni efekt indukcyjny (+I). Na poniższym schemacie przedstawiono kierunek i wielkość efektu indukcyjnego wybranych podstawników względem wodoru.
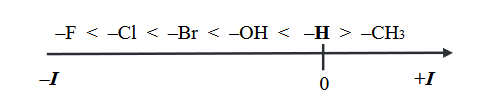
Odpowiedz na poniższe pytania i uzasadnij odpowiedź. W uzasadnieniu porównaj wpływ podstawników na efekt indukcyjny.
1. Czy kwas 2-chloropropanowy jest mocniejszy niż kwas 2-hydroksypropanowy?
(TAK / NIE), ponieważ:
2. Czy 2-hydroksypropanoamina jest mocniejszą zasadą niż propanoamina?
(TAK / NIE), ponieważ:
Parabeny – konserwanty stosowane w kosmetykach
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Parabeny – środki konserwujące powszechnie stosowane w kosmetykach – są estrami kwasu para-hydroksybenzoesowego (kwasu 4-hydroksybenzenokarboksylowego). Do parabenów należy 4-hydroksybenzoesan benzylu – ester kwasu 4-hydroksybenzenokarboksylowego i alkoholu benzylowego, czyli fenylometanolu.
Napisz wzór uproszczony 4-hydroksybenzoesanu benzylu.
kąty pomiędzy wiązaniami tworzonymi przez atomy
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Badania wykazały, że atomy tworzące wiązanie peptydowe stanowią sztywny i płaski element strukturalny. Mała odległość między atomem węgla a atomem azotu, które tworzą to wiązanie, wskazuje, że w znacznym stopniu ma ono charakter wiązania podwójnego (około 50%). W rezultacie kąty między wiązaniami tworzonymi przez opisane atomy są zbliżone do 120º. Wiązanie peptydowe może być opisane jako stan pośredni między dwiema strukturami zilustrowanymi poniżej na przykładzie fragmentu łańcucha peptydowego (R1 i R2 oznaczają łańcuchy boczne aminokwasów):
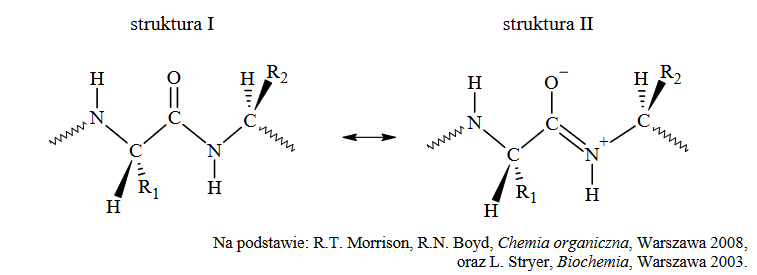
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

rzędowość atomów węgla w cząsteczce węglowodoru
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Napisz wzór półstrukturalny (grupowy) alkanu o wzorze C₆H₁₄, w którego cząsteczce występuje czwartorzędowy atom węgla. Napisz nazwę systematyczną tego alkanu. Określ liczbę monochloropochodnych będących izomerami konstytucyjnymi, które mogą powstać w procesie chlorowcowania opisanego węglowodoru.
Wzór:
Nazwa systematyczna:
Liczba izomerycznych monochloropochodnych:
Dieny – węglowodory z podwójnymi wiązaniami węgiel – węgiel
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Dieny to węglowodory, w których cząsteczkach występują dwa podwójne wiązania węgiel – węgiel. W zależności od rozmieszczenia tych wiązań w cząsteczce dzielą się na trzy
grupy:
1) ze sprzężonym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel występują na przemian z wiązaniami pojedynczymi
2) z izolowanym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel są oddzielone od siebie więcej niż jednym wiązaniem pojedynczym
3) ze skumulowanym układem wiązań podwójnych, w których cząsteczkach wiązania podwójne węgiel – węgiel nie są oddzielone wiązaniem pojedynczym.
Poniżej przedstawiono wzory pięciu dienów oznaczone numerami I–V.
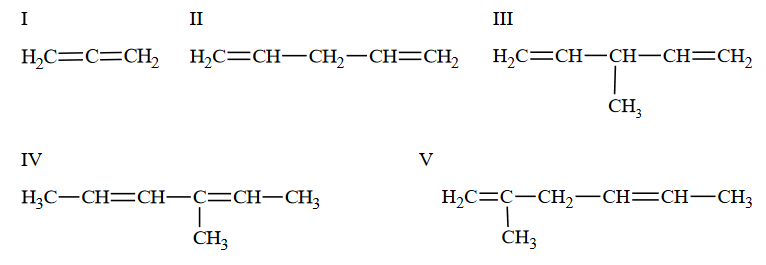
Powyższe związki podziel na dieny ze sprzężonym, izolowanym i skumulowanym układem wiązań podwójnych. Wpisz do tabeli numery, którymi oznaczono ich wzory.