Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
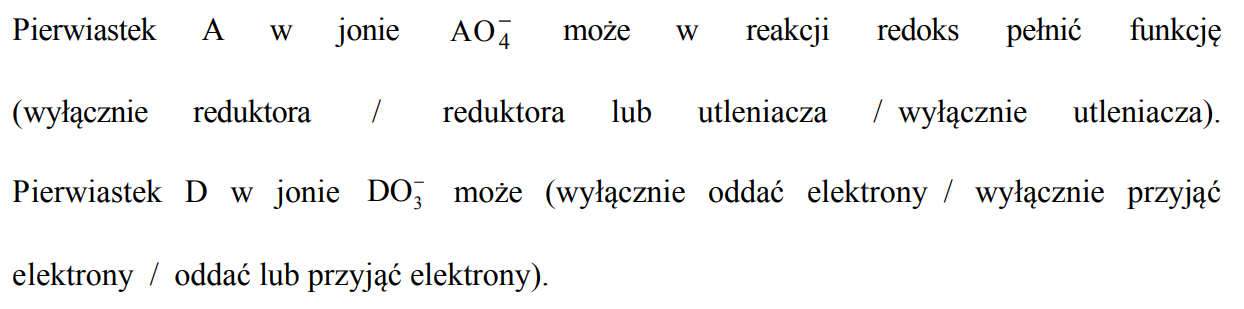
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa
wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu,
a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.
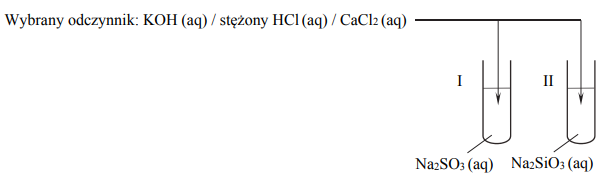
Napisz, co zaobserwowano w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian.
Równanie reakcji przebiegającej w probówce I:
Równanie reakcji przebiegającej w probówce II:
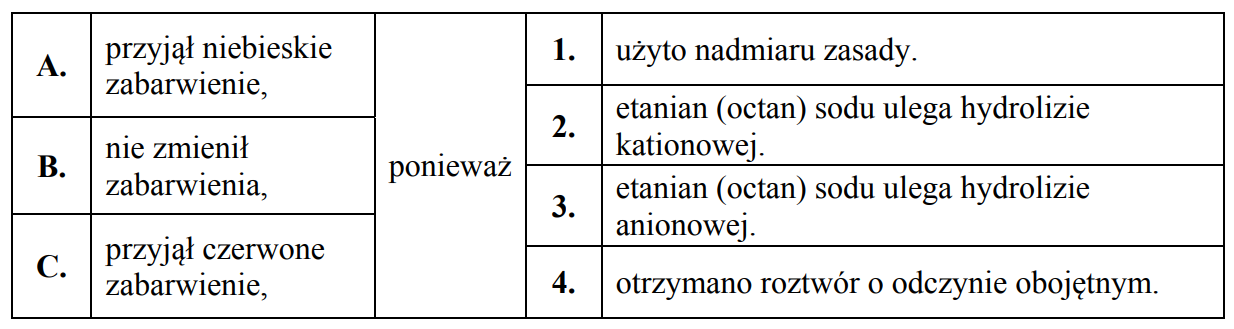
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwórzawierający 0,1 mola kwasu etanowego (octowego).
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwór
zawierający 0,1 mola kwasu etanowego (octowego). Następnie w mieszaninie poreakcyjnej zanurzono żółty uniwersalny papierek wskaźnikowy.
Dokończ poniższe zdanie. Wybierz i zaznacz odpowiedź A, B albo C i jej uzasadnienie 1., 2., 3. albo 4.
Uniwersalny papierek wskaźnikowy
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa, 1994.
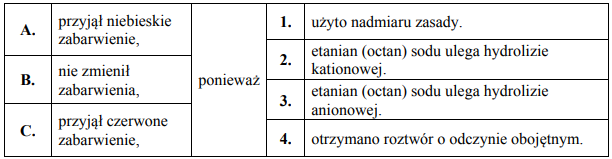
Jedną z opisanych reakcji przedstawia poniższy schemat
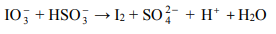
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie procesu redukcji:
Równanie procesu utleniania:
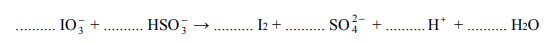
Reakcja anionu tlenkowego z cząsteczką wody.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Reakcja anionu tlenkowego z wodą.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Aniony tlenkowe w sieci krystalicznej.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje
z cząsteczką wody.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastków mających (małą / dużą) elektroujemność i należących do grup układu okresowego o numerach: (1 i 2 / 14 i 15 / 16 i 17). Ulegające reakcji z wodą tlenki tych pierwiastków
tworzą roztwory o silnie (kwasowym / zasadowym) odczynie, a więc o (niskim / wysokim) pH.
Reakcje cynku z kwasem solnym i octowym.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Przeprowadzono doświadczenie, w którym do probówki I wlano kwas solny o pH = 2, a do probówki II – wodny roztwór kwasu octowego (etanowego) o pH = 2. Roztwory miały temperaturę 298 K. Następnie do obu probówek dodano po 1 gramie pyłu
cynkowego. Opisane doświadczenie zilustrowano poniższym schematem.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Papierek wskaźnikowy, barwy w kwasie octowym i roztworze zasady sodowej.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwór zawierający 0,1 mola kwasu etanowego (octowego). Następnie w mieszaninie poreakcyjnej
zanurzono żółty uniwersalny papierek wskaźnikowy.
Dokończ poniższe zdanie. Wybierz i zaznacz odpowiedź A, B albo C i jej uzasadnienie 1., 2., 3. albo 4.
Uniwersalny papierek wskaźnikowy
Wpływ na szybkość reakcji oraz na stałą równowagi.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Tlenek azotu(II) można otrzymać w łuku elektrycznym w wyniku endotermicznej reakcji odwracalnej zilustrowanej poniższym równaniem.
N2 (g) + O2 (g) ⇄ 2NO (g)
Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej.
zmaleje
wzrośnie
nie ulegnie zmianie
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost temperatury, to wartość stałej równowagi opisanej reakcji ………………………………………… .
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost ciśnienia (T=const), to wydajność opisanej reakcji ………………………………………… .
Jeśli do układu będącego w stanie równowagi wprowadzi się katalizator, to ilość NO w układzie ………………………………………… .
Jeśli z układu będącego w stanie równowagi usunie się część azotu, to ilość tlenu w układzie ………………………………………… .

Otrzymywanie wodnych roztworów soli.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
W temperaturze T stała dysocjacji kwasowej kwasu etanowego (octowego) jest równa Ka = 1,8 · 10–5, a stała dysocjacji zasadowej amoniaku jest równa Kb = 1,8 · 10–5.
Przeprowadzono doświadczenie, w którym po zmieszaniu reagentów w stosunku stechiometrycznym powstały wodne roztwory soli o temperaturze T. Odczyn roztworu wodnego otrzymanej soli:
• w probówce I był zasadowy;
• w probówce II – kwasowy;
• w probówce III – obojętny.
Uzupełnij schemat przeprowadzonego doświadczenia. Wpisz wzory użytych odczynników wybranych spośród:
NH3 (aq)
CO2 (g)
K (s)
HCl(aq)
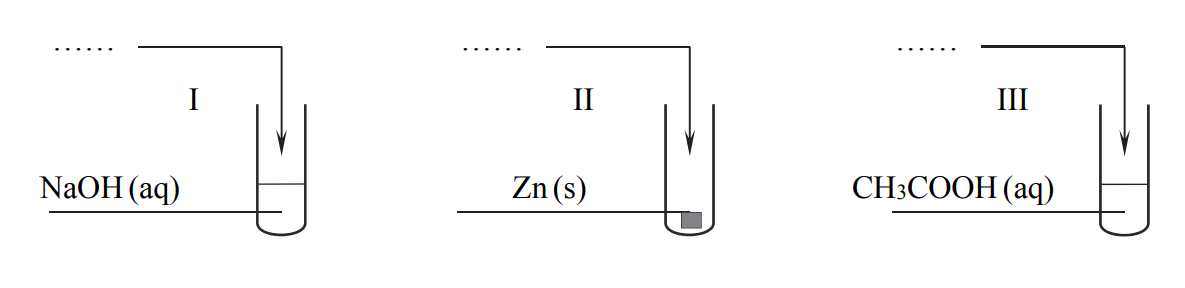
Napisz w formie jonowej skróconej równanie reakcji otrzymywania tej soli, której wodny roztwór powstał w probówce I.
…………………………………………………………………………………………………..
Reakcja dysproporcjonowania kwasu fosfonowego.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Podczas ogrzewania kwas fosfonowy H3PO3 (H2PHO3) ulega reakcji dysproporcjonowania, w wyniku której powstają kwas ortofosforowy(V) i fosforowodór.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie cząsteczkowej równanie opisanej reakcji.
Reakcje siarczanu (IV) sodu i krzemianu sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.

Napisz, co można zaobserwować w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian.
Równanie reakcji przebiegającej w probówce I:
Równanie reakcji przebiegającej w probówce II:
Kwasy i zasady w teorii Brønsteda–Lowry’ego
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Dany jest zbiór drobin:
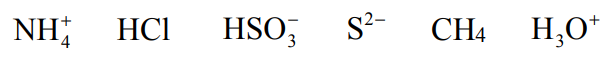
Spośród podanych drobin wybierz wszystkie, które według teorii Brønsteda–Lowry’ego mogą w roztworze wodnym pełnić funkcję zasady. Napisz odpowiednie wzory. Dla jednej z wybranych drobin napisz równanie reakcji z wodą, w której to reakcji wybrana drobina pełni funkcję zasady.
Wzory drobin, które mogą pełnić funkcję zasady:
Równanie reakcji wybranej drobiny z wodą:
pH fenolu, kwasu solnego, metyloaminy i alkoholu etylowego.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła

Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów – zapisz wzory tych związków w odpowiedniej kolejności. Napisz w formie jonowej równanie reakcji, która uzasadnia odczyn roztworu o najwyższym pH.
Kolejność związków zgodnie z rosnącym pH roztworów:
Równanie reakcji, która uzasadnia odczyn roztworu o najwyższym pH: