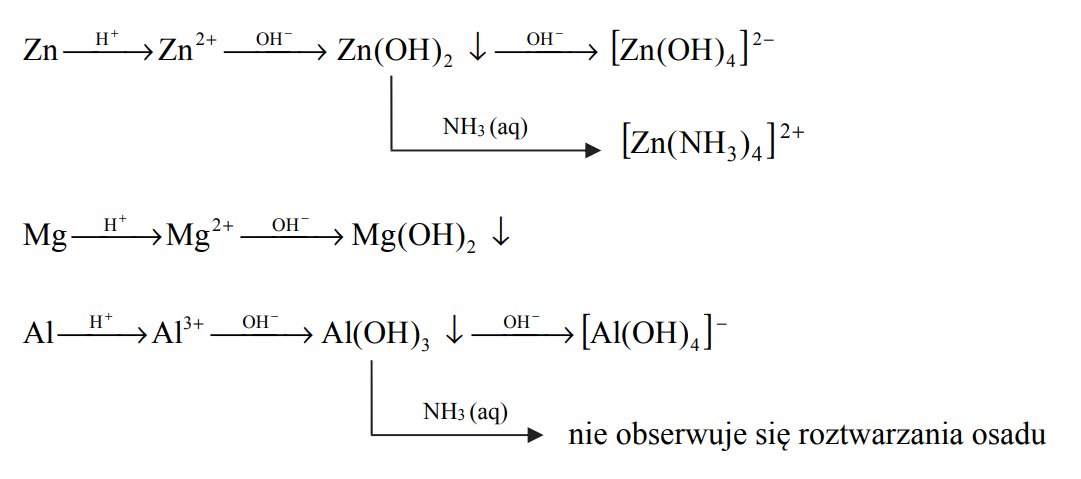
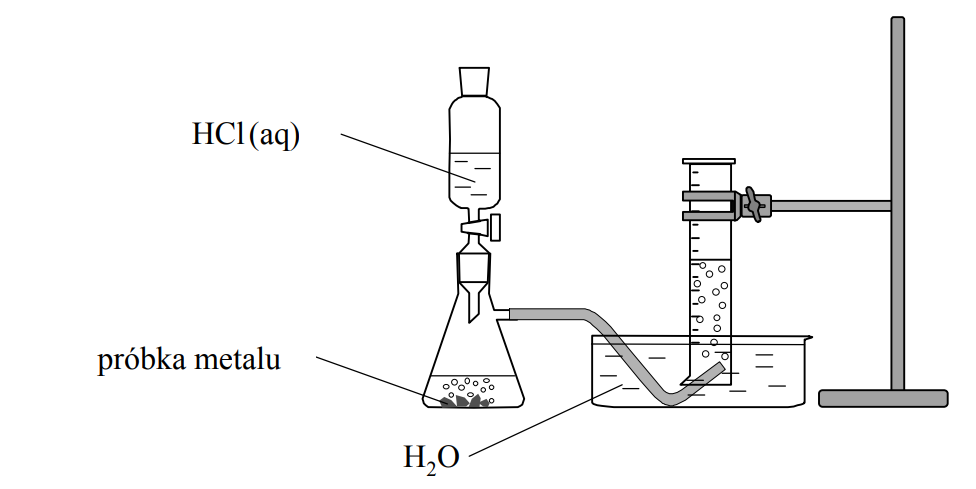
Zadanie 42.
2004 grudzień
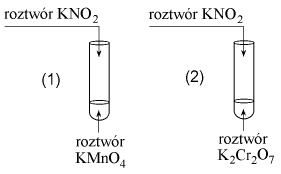
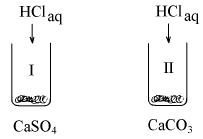
Przeprowadzono następujące doświadczenie:
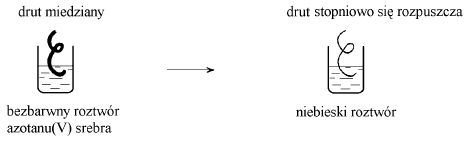
Wyjaśnij przebieg tego doświadczenia.
Równanie reakcji anionu tlenkowego z cząsteczką wody.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon
tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Napisz równanie reakcji anionu tlenkowego z cząsteczką wody.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastkówmających…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Anion tlenkowy O2– jest zasadą Brønsteda mocniejszą niż jon wodorotlenkowy OH–. Jon
tlenkowy nie występuje w wodnych roztworach, ponieważ jako bardzo mocna zasada reaguje z cząsteczką wody.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Aniony tlenkowe występują w sieci krystalicznej jonowych tlenków pierwiastków
mających (małą / dużą) elektroujemność i należących do grup układu okresowego
o numerach: (1 i 2 / 14 i 15 / 16 i 17). Ulegające reakcji z wodą tlenki tych pierwiastków
tworzą roztwory o silnie (kwasowym / zasadowym) odczynie, a więc o (niskim / wysokim)
pH.
Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX+H2O ⇄ + − H3O + X
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).
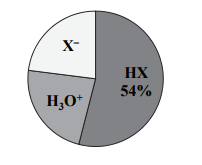
Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu.
Temperatura roztworu nie uległa zmianie.
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stopnia dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stałej dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodniez równaniem:
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie
z równaniem:
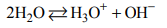
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona
równaniem:
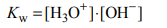
Poniżej przedstawiono wartości iloczynu jonowego wody Kw w zakresie temperatury
0 ºC–100 ºC (pod ciśnieniem atmosferycznym).

Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Reakcja autodysocjacji wody jest (egzoenergetyczna / endoenergetyczna). Wraz ze wzrostem temperatury pH czystej wody (maleje / rośnie / nie ulega zmianie).
Zdolność autoprotolizy charakteryzuje nie tylko wodę..
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie
z równaniem:
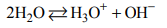
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona
równaniem:
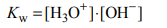
Zdolność autoprotolizy charakteryzuje nie tylko wodę, lecz także inne rozpuszczalniki, np.: ciekły amoniak (skroplony pod zwiększonym ciśnieniem), metanol i kwas mrówkowy.
Napisz trzy równania reakcji autoprotolizy: ciekłego amoniaku, metanolu i kwasu
mrówkowego. Zastosuj wzory półstrukturalne (grupowe) organicznych produktów
reakcji.

Wyjaśnij, dlaczego cząsteczki amoniaku, metanolu i kwasu mrówkowego mają zdolność odszczepiania i przyłączania protonu w procesie autoprotolizy. Odnieś się do budowy tych cząsteczek.
Cząsteczki wymienionych związków mają zdolność odszczepiania protonu, ponieważ:
Cząsteczki wymienionych związków mają zdolność przyłączania protonu, ponieważ:
Zdolność elektrolitu do dysocjacji zależy od właściwości tego elektrolitu oraz od właściwości użytego rozpuszczalnika.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Zdolność elektrolitu do dysocjacji zależy od właściwości tego elektrolitu oraz od właściwości użytego rozpuszczalnika. Im silniejszą zasadą Brønsteda jest rozpuszczalnik, tym w większym stopniu dysocjuje w nim elektrolit będący kwasem Brønsteda.
Zbadano dysocjację jednoprotonowego kwasu HA w różnych rozpuszczalnikach. W wodzie HA jest słabym kwasem.
Uzupełnij poniższe zdanie. Wybierz i zaznacz nazwę rozpuszczalnika.
W danej temperaturze wartość stałej dysocjacji kwasu HA jest największa w roztworze,
w którym rozpuszczalnikiem jest (ciekły amoniak / kwas mrówkowy / metanol / woda).