Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56. Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt,
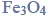
Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku
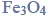
żelazo tworzy jeszcze 2 inne tlenki:
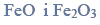
W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
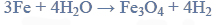
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie. Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
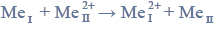
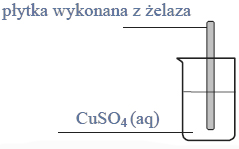
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podst.: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934;
M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Substancję, którą otrzymano w reakcji 3., rozpuszczono w wodzie i otrzymany roztwór wykorzystano jako odczynnik wyjściowy do przeprowadzenia doświadczenia, w którego wyniku otrzyma się najpierw wodorotlenek, a następnie odpowiedni tlenek żelaza.
Zaprojektuj doświadczenie, w którego wyniku otrzymasz najpierw wodorotlenek, a następnie odpowiedni tlenek żelaza.
a) Opisz sposób wykonania poszczególnych etapów doświadczenia. Uwzględnij w nim wzory lub nazwy użytych odczynników.
b) Napisz w formie cząsteczkowej równania reakcji, które przebiegną podczas wykonywanego doświadczenia. Zaznacz warunki prowadzenia procesu, jeśli dana przemiana tego wymaga.