dobieranie współczynników w równaniach reakcji chemicznych
Arkusz z chemii rozszerzonej marzec 2021
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.).
Równanie 1.:
Równanie 2.:
kwasy i zasady Brønsteda
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Kwas fosfonowy o wzorze sumarycznym H₃PO₃ jest kwasem dwuprotonowym, którego wzór można zapisać jako H₂PHO₃. Struktura cząsteczki tego kwasu jest następująca:
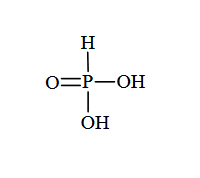
Napisz równanie reakcji ostatniego etapu dysocjacji kwasu H 2 PHO3 w wodzie w ujęciu teorii Brønsteda. Określ, jaką funkcję – kwasu czy zasady Brønsteda – pełni w tej reakcji woda.
Równanie reakcji:
Funkcja wody:
Uwodniony węglan sodu – bezbarwny kryształ
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Węglan sodu występuje w postaci soli bezwodnej oraz w postaci hydratu zawierającego 63% masowych wody. Obie formy rozpuszczają się w wodzie. Uwodniony węglan sodu tworzy
bezbarwne kryształy, które podczas ogrzewania uwalniają wodę krystalizacyjną i rozpuszczają się w niej.
Rozpuszczalność węglanu sodu (w przeliczeniu na sól bezwodną) w temperaturze 40 °C jest równa 48,8 g na 100 g wody.
1. Wykonaj obliczenia i ustal wzór opisanego hydratu węglanu sodu.
2. Na podstawie obliczeń rozstrzygnij, czy węglan sodu zawarty w opisanym hydracie całkowicie rozpuści się w wodzie krystalizacyjnej w temperaturze 40 °C.
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

określanie zawartości substancji w mieszaninach – procenty masowe
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Mieszaninę azotanu(V) wapnia Ca(NO3 ) 2 i chlorku baru BaCl 2 o masie 10 g rozpuszczono całkowicie w wodzie, w wyniku czego otrzymano 100 cm3 roztworu. W celu ustalenia składu mieszaniny soli pobrano 20 cm3 otrzymanego roztworu, a następnie przeprowadzono reakcję:
Ag⁺ + Cl⁻ → AgCl ↓
Na wytrącenie jonów chlorkowych zawartych w 20 cm3 roztworu zużyto 40 cm3 wodnego roztworu azotanu(V) srebra AgNO3 o stężeniu 0,3 mol∙dm⁻³ .
Oblicz w procentach masowych zawartość azotanu(V) wapnia i chlorku baru w opisanej mieszaninie.
reakcje zachodzące w roztworach wodnych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
W zlewce umieszczono świeżo przygotowany roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI).
Zaplanuj doświadczenie, które w następujących po sobie etapach I–III umożliwi wydzielenie z opisanego roztworu – przez wytrącenie osadów soli – kolejno wszystkich anionów kwasów tlenowych. Napisz w odpowiedniej kolejności wzory odczynników oraz wzory wytrąconych soli.
Odczynniki: BaCl₂(aq) MgCl₂(aq) CuCl₂(aq)
reakcje zachodzące w roztworach wodnych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Do probówki ze stałym etanianem (octanem) sodu dodano kwas siarkowy(VI) i zawartość naczynia ogrzano. U wylotu probówki wyczuwalny był charakterystyczny ostry zapach.
1. Napisz, czy użycie do przeprowadzenia opisanego doświadczenia kwasu ortofosforowego(V) zamiast kwasu siarkowego(VI) pozwoli na zaobserwowanie podobnych efektów.
2. W dwóch nieopisanych probówkach znajdują się wodne roztwory dwóch soli (każdy roztwór w innej probówce). Wiadomo, że jednym roztworem jest wodny roztwór etanianu (octanu) magnezu, a drugim – wodny roztwór etanianu (octanu) sodu.
Oceń, czy po dodaniu wodnego roztworu kwasu ortofosforowego(V) do obu probówek i ogrzaniu ich zawartości możliwe będzie wskazanie, w której probówce znajdował się wodny roztwór etanianu magnezu, a w której – wodny roztwór etanianu sodu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
obliczenia związane z przygotowaniem roztworów
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Kwas etanodiowy o wzorze (COOH)2 jest najprostszym kwasem dikarboksylowym, którego rozpuszczalność w wodzie w temperaturze 20 ºC jest równa 9,52 g bezwodnego kwasu w 100 g wody.
Oblicz minimalną masę wody potrzebną do rozpuszczenia 14,0 gramów hydratu kwasu etanodiowego o wzorze (COOH)₂ · 2H₂O w temperaturze 20 ºC. Wynik końcowy podaj w gramach i zaokrąglij do jedności.
kwasy i zasady – klasyfikacja zgodna z teorią Brønsteda–Lowry`ego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Jon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
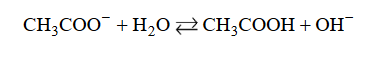
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:
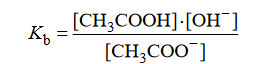
Iloczyn stałej dysocjacji kwasowej Ka kwasu CH₃COOH i stałej dysocjacji zasadowej Kb sprzężonej z nim zasady CH3COO⁻ jest równy iloczynowi jonowemu wody: Ka∙Kb = Kw. W temperaturze 25ºC iloczyn jonowy wody jest równy Kw = 1, 0 * 10⁻¹⁴.
Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 mol*dm⁻³ w temperaturze 25 ºC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych
Przygotowanie 200gramów 10% wodnego roztworu glukozy
Arkusz maturalny z chemii podstawowej maj 2005
Czterech uczniw miało za zadanie przygotować 200 gramów 10% wodnego roztworu glukozy, mając do dyspozycji: glukozę, wodę destylowaną, wagę laboratoryjną techniczną z kompletem odważnikw, cylinder miarowy, szkiełko zegarkowe i zlewkę (gęstość wody d=1g•cm-3). Polecenie wykonali następująco:

Wskaż, który uczeń prawidłowo wykonał polecenie:

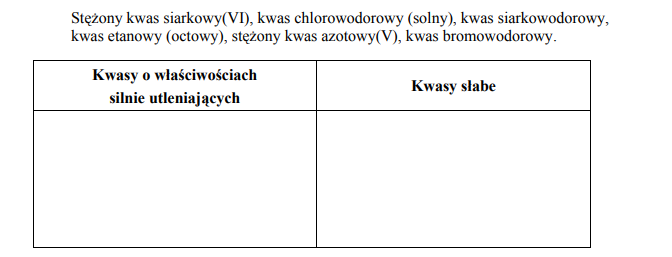
Przykłady kwasów silnie utleniających i kwasów słabych.
Arkusz maturalny z chemii podstawowej maj 2005
Z podanego poniżej zbioru kwasów wybierz i wpisz do tabeli te, które można zaliczyć do odpowiednich grup.
Reakcja wodorotlenku sodu z kwasem ortofosforowym(V)
Arkusz maturalny z chemii podstawowej maj 2005
Na podstawie równania reakcji zapisanego w formie cząsteczkowej podaj, w jakim stosunku molowym i masowym reaguje wodorotlenek sodu z kwasem ortofosforowym(V), jeżeli jedynymi produktami są sól obojętna i woda.
Cząsteczkowe równanie reakcji:
Stosunek molowy wodorotlenku do kwasu:
Stosunek masowy wodorotlenku do kwasu:
Reakcje strąceniowe.
Arkusz maturalny z chemii podstawowej maj 2005
W laboratorium uczeń chciał otrzymać trudno rozpuszczalne związki i wykonał doświadczenia przedstawione na poniższym rysunku:
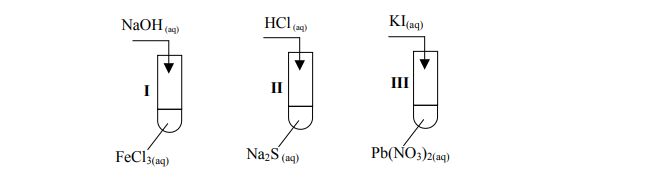
Wskaż, w której probówce nie wytrącił się osad?
Osad nie wytrącił się w probówce:
Utlenianie siarczku miedzi(II) kwasem azotowym(V)
Arkusz maturalny z chemii podstawowej maj 2005
Dobierz współczynniki stechiometryczne metodą bilansu elektronowego w równaniu pierwszego etapu reakcji utleniania siarczku miedzi(II) kwasem azotowym(V):
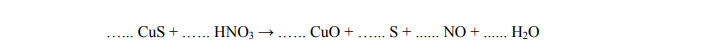
Bilans elektronowy