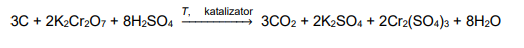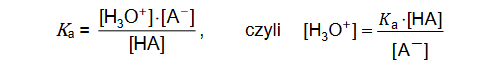wodne roztwory jodku potasu
INFORMATOR o egzaminie maturalnym z chemii 22/23
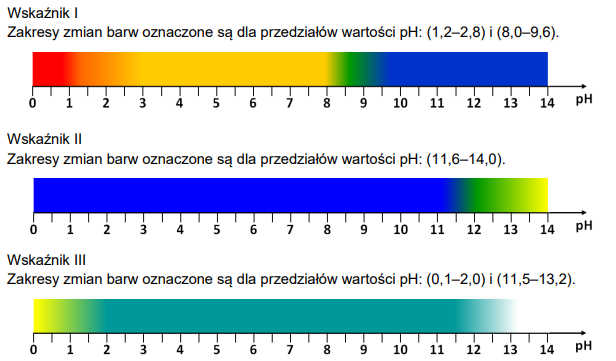
W poniższych tabelach zamieszczone są dane dotyczące wodnych roztworów jodku potasu.
Tabela 1. Zależność rozpuszczalności jodku potasu (KI) od temperatury
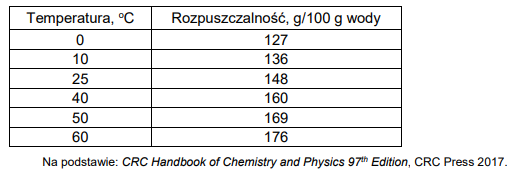
Tabela 2. Zależność gęstości roztworów jodku potasu od stężenia (t = 20 °C)
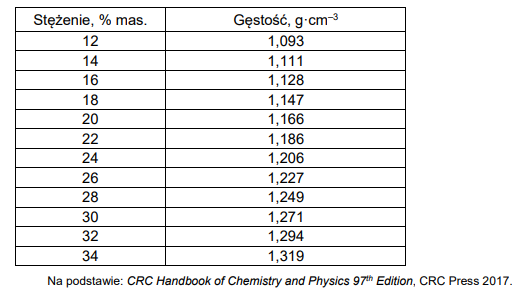
Przygotowano 100 g wodnego roztworu jodku potasu w temperaturze t = 20°C, a następnie go rozcieńczono, dodając 195 g wody i utrzymując stałą temperaturę 20°C.
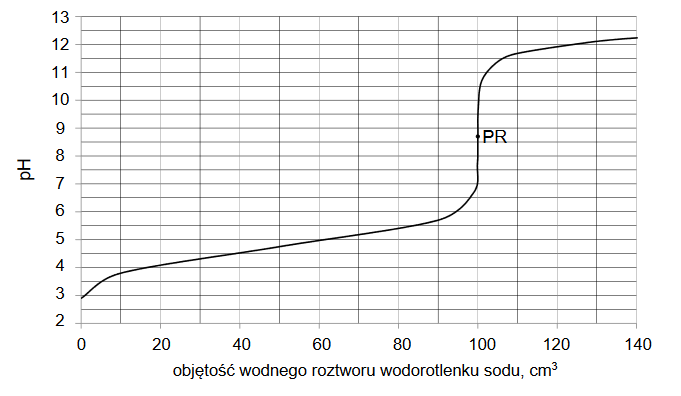
Na podstawie zamieszczonych informacji narysuj wykres zależności rozpuszczalności jodku potasu od temperatury, a następnie oblicz stężenie molowe roztworu otrzymanego po zmieszaniu 100 g roztworu nasyconego i 195 g wody w temperaturze 20°C.
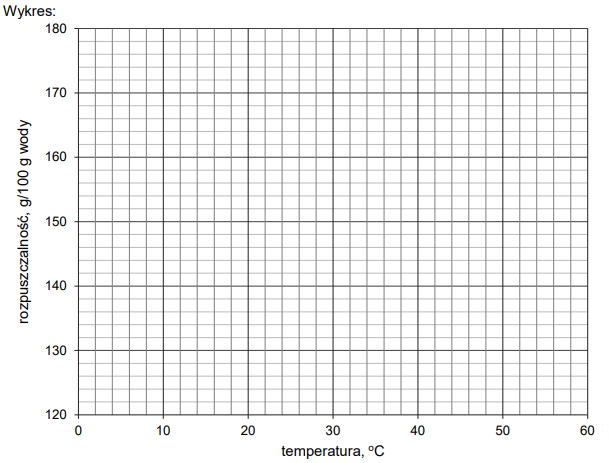
Obliczenia:
Rozróżnianie malinowych roztworów wodnych
INFORMATOR o egzaminie maturalnym z chemii 22/23
W dwóch kolbach znajdują się dwa różne, ale podobnie wyglądające roztwory wodne:

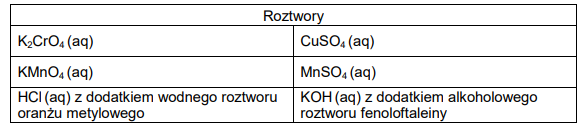
1. Spośród wymienionych niżej roztworów wybierz te, które mogą wyglądać tak jak roztwory pokazane na ilustracjach. Zaznacz ich wzory lub nazwy.
2. Przeprowadzono dwa niezależne doświadczenia, w których do roztworów z obu naczyń dodano jeden taki sam odczynnik. W każdym z tych doświadczeń nastąpiła wyraźna zmiana barwy tylko jednego roztworu.
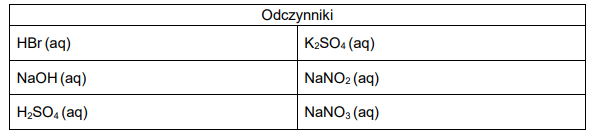
Wybierz dwa odczynniki, z których każdy po dodaniu (w odpowiedniej ilości) do obu badanych roztworów spowoduje wyraźną zmianę barwy tylko jednego z nich. Zaznacz wzory wybranych odczynników.
3. Napisz w formie jonowej skróconej równania reakcji, których przebieg był przyczyną zmiany barwy roztworu z każdego naczynia.
Działanie kwasu solnego na węglan wapnia – doświadczenie
INFORMATOR o egzaminie maturalnym z chemii 22/23
Uczniowie wykonywali doświadczenie, podczas którego działali kwasem solnym na węglan wapnia, w zestawie umożliwiającym pochłanianie wydzielającego się CO2 w roztworze KOH. Naczynie z tym roztworem miało być zważone przed doświadczeniem i po jego zakończeniu.
Reakcje wydzielania i pochłaniania CO2 opisują równania:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO2 + 2KOH → K2CO3 + H2O
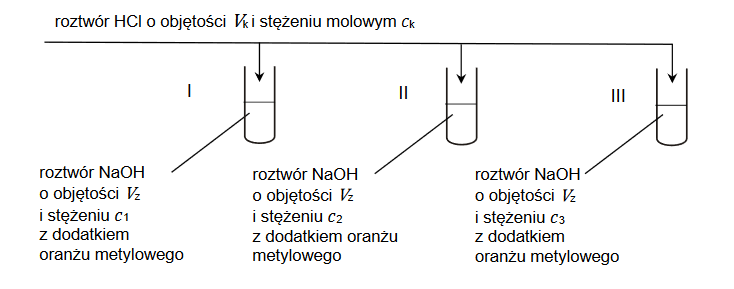
Węglan wapnia był stosowany w nadmiarze, natomiast kwas solny miał nieznane stężenie, ale mógł zostać dokładnie odmierzony. Na podstawie jego objętości oraz przyrostu masy naczynia z KOH, uczniowie mieli oszacować stężenie roztworu HCl. Swoje pomiary zapisali w poniższej tabeli:
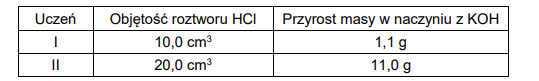
Okazało się, że jeden z uczniów błędnie zmierzył lub błędnie zapisał przyrost masy.
Oblicz stężenie molowe badanego roztworu na podstawie wyników ucznia I i ucznia II. Wskaż ucznia, który poprawnie wykonał doświadczenie. Odpowiedź uzasadnij.
Reakcje w roztworach wodnych
INFORMATOR o egzaminie maturalnym z chemii 22/23
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
NaCl
CH3COOH
Ba(OH)2
NaNO2
HBr
1. Uszereguj związki o podanych wzorach zgodnie ze wzrastającym stężeniem jonów OH− ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.
2. Napisz wzory tych związków, których wodne roztwory po dodaniu do nich wodnego roztworu oranżu metylowego zabarwią się na czerwono.
mieszanina dwóch słabych kwasów jednoprotonowych
INFORMATOR o egzaminie maturalnym z chemii 22/23
W praktyce analitycznej stosuje się roztwory zawierające mieszaninę dwóch kwasów lub zasad. Jeżeli roztwór zawiera mieszaninę dwóch słabych kwasów jednoprotonowych, można przyjąć z pewnym przybliżeniem, że stężenie jonów hydroniowych w tym roztworze jest równe:
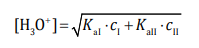
gdzie:
KaI i KaII – stałe dysocjacji kwasów
cI i cII – stężenia kwasów w otrzymanej mieszaninie.
W temperaturze T zmieszano 50,0 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 0,10 mol · dm–3 z 50,0 cm3 wodnego roztworu kwasu etanowego (octowego) o stężeniu 0,10 mol · dm–3 . W temperaturze T stała dysocjacji kwasu metanowego jest równa 1,77 · 10–4, a stała dysocjacji kwasu etanowego wynosi 1,75 · 10–5.
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Przykład buforu – mieszanina roztworu octanu sodu i roztworu kwasu octowego
INFORMATOR o egzaminie maturalnym z chemii 22/23
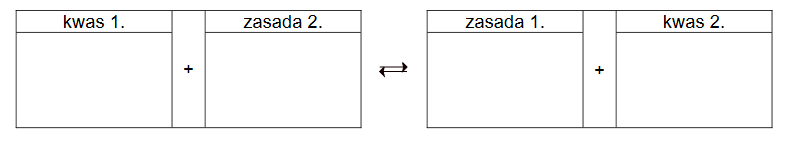
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga
chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
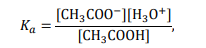
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
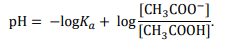
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
1. Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
HCl
NaOH
NH4Cl
NaCl
2. Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm−3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm−3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.
Wartość iloczynu rozpuszczalności wodorotlenku wapnia
INFORMATOR o egzaminie maturalnym z chemii 22/23
W kolbie umieszczono 1,0 g tlenku wapnia, dodano 100 cm3 wody, wymieszano i kolbę zamkniętą korkiem pozostawiono na kilka godzin. Następnie pobrano trochę roztworu i w temperaturze 25 °C zmierzono jego pH. Po pewnym czasie pomiar powtórzono, ale wartość pH nie zmieniła się i wynosiła 12,33. Przyjęto, że cały tlenek wapnia przereagował zgodnie z równaniem:
CaO + H2O → Ca(OH)2
i ustaliła się równowaga między fazą stałą a roztworem:
Ca(OH)2 ⇄ Ca2+ + 2OH−
Oblicz wartość iloczynu rozpuszczalności (Ks) wodorotlenku wapnia w warunkach doświadczenia.
Odwracalny proces autodysocjacji wody ciężkiej
INFORMATOR o egzaminie maturalnym z chemii 22/23
Woda ciężka (tlenek deuteru, D2O), której cząsteczki zawierają deuter – izotop wodoru ²H, podobnie jak zwykła woda, ulega odwracalnemu procesowi autodysocjacji opisanemu równaniem:
2D2O ⇄ D3O+ + OD−.
Proces autodysocjacji można opisać stałą dysocjacji K D₂O zależną od temperatury.
Wygodnym sposobem posługiwania się stałą dysocjacji jest wyrażenie jej wartości w formie zlogarytmowanej: pK D O2 = − logK D₂O .
Zestawienie wartości pK D₂O w różnych temperaturach podano w tabeli.
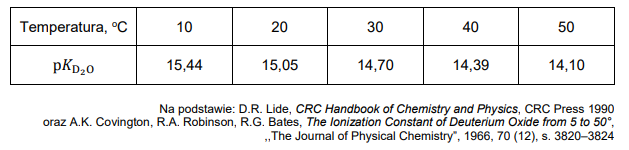
Wartość pK H₂O (pKw) dla procesu autodysocjacji wody zwykłej w temperaturze 25°C wynosi 14,00.
Narysuj wykres zależności p𝐾𝐾D2O od temperatury i oblicz stężenie molowe jonów OD⁻ w ciężkiej wodzie w temperaturze 25°C. Rozstrzygnij, który proces dysocjacji – D₂O czy H₂O – zachodzi w większym stopniu w temperaturze 25°C.
Obliczenia:
chemiczna podstawa metody pokrywania karoserii samochodowych powłokami
INFORMATOR o egzaminie maturalnym z chemii 22/23
Poniżej przedstawiono opis jednej z najnowocześniejszych, a jednocześnie powszechnie stosowanej metody pokrywania karoserii samochodowych powłokami antykorozyjnymi lub dekoracyjnymi.
Do malowania wykorzystuje się farby tworzące z wodą układy koloidalne. Malowanie zachodzi w wyniku przepływu prądu elektrycznego. W polu elektrycznym obdarzone ładunkiem elektrycznym koloidalne cząstki farby poruszają się do elektrody, którą jest karoseria samochodu. Proces nakładania powłoki prowadzi się z zastosowaniem prądu stałego o określonym napięciu.
Zaznacz nazwę zjawiska stanowiącego podstawę opisanego procesu.
A. elektroliza
B. elektroforeza
C. ekstrakcja
D. sedymentacja