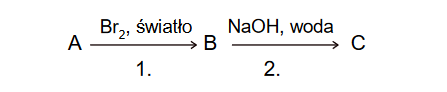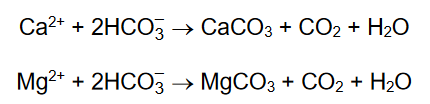Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Oblicz, ile gramów soli uwodnionej Na2SO4 10H2O należy dodać do 100 g roztworu, w którym stężenie Na2SO4 wynosi 6,0 % masowych, aby – po uzupełnieniu wodą do 300 g – otrzymać roztwór tej soli o stężeniu 10 %. W obliczeniach przyjmij, że masy molowe soli są równe:
M Na2SO4 = 142 g ∙ mol–1 oraz
M Na2SO4 ∙10H2O = 322 g ∙ mol–1 .
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 ºC – 100 ºC.
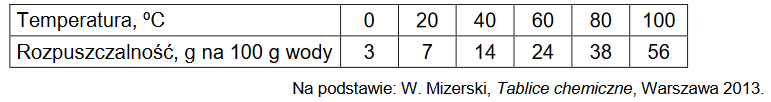
1. Narysuj krzywą rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 ºC – 100 ºC. Rozpuszczalność tej soli w wodzie jest funkcją rosnącą w całym podanym zakresie temperatury.
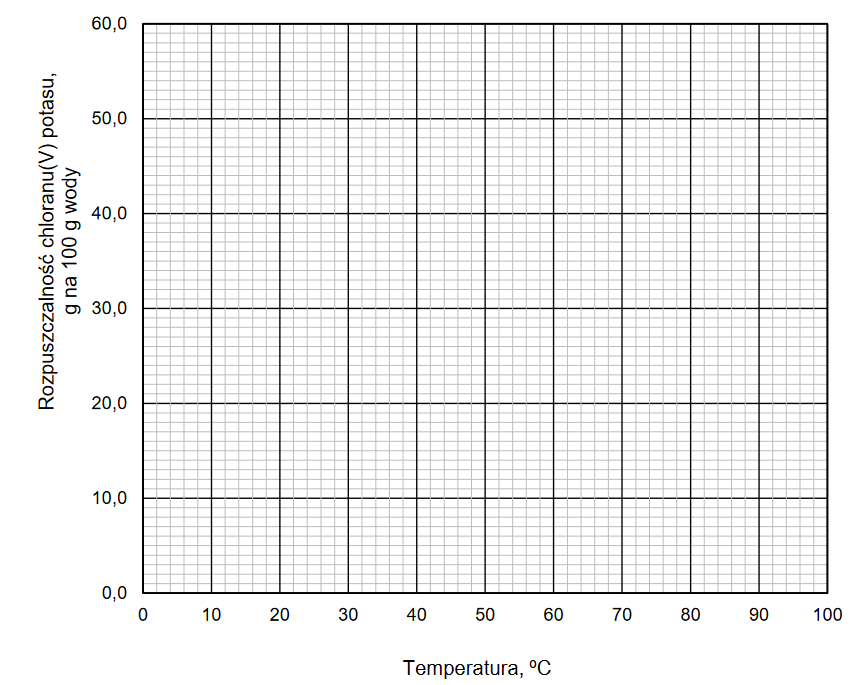
2. Rozstrzygnij, czy w temperaturze 20 ºC można otrzymać roztwór chloranu(V) potasu o stężeniu 7 % masowych. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
3. Wykonaj obliczenia i odczytaj z wykresu wartość temperatury, w której nasycony roztwór chloranu(V) potasu ma stężenie 30 % masowych. Wartość temperatury podaj w zaokrągleniu do jedności.
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Przygotowano roztwór bromu w dichlorometanie (rozpuszczalniku organicznym o wzorze CH2Cl2) o stężeniu 2,0 % masowych. Przez płuczkę zawierającą 280 gramów opisanego roztworu bromu przepuszczano bez dostępu światła mieszaninę etanu, etenu i etynu.
Podczas doświadczenia przebiegły wyłącznie reakcje zilustrowane poniższymi równaniami:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
Do momentu całkowitego odbarwienia roztworu bromu przez płuczkę przepuszczono 521 cm3 mieszaniny gazów (objętość gazów podano w przeliczeniu na warunki normalne). Ustalono także, że po przejściu przez płuczkę objętość mieszaniny gazów była mniejsza o 86 %.
Oblicz wyrażoną w procentach objętościowych zawartość etynu w mieszaninie zawierającej etan, eten i etyn.
Reakcje w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
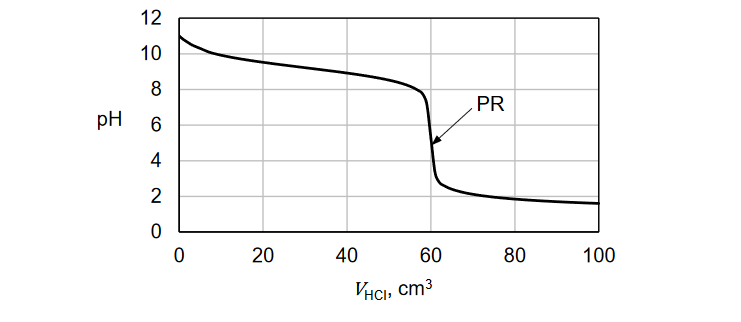
Do zlewki wprowadzono 80 cm3 roztworu mocnego (całkowicie zdysocjowanego), jednoprotonowego kwasu HA o stężeniu 0,10 mol · dm–3. Następnie do zlewki wprowadzono 45 cm3 roztworu wodorotlenku potasu o stężeniu 0,15 mol · dm–3. Do takiej mieszaniny dodawano kroplami roztwór wodorotlenku sodu o stężeniu 0,2 mol · dm–3 do momentu uzyskania roztworu o pH równym 2,1.
Oblicz objętość dodanego roztworu wodorotlenku sodu. Przyjmij, że objętość mieszaniny była sumą objętości zmieszanych roztworów.
Reakcje w rozworze wodnym z wytworzeniem osadu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Wykonano doświadczenie, którego celem było otrzymanie pewnej substancji chemicznej.
Postępowano zgodnie z poniższą instrukcją:
Odważyć 5 g CuSO4·5H2O, umieścić w kolbie stożkowej i dodać 15 cm3 wody destylowanej.
Roztwór w kolbie mieszać i ogrzać w łaźni wodnej do temperatury około 60 °C.
W tej temperaturze dodawać powoli porcjami nadmiar pyłu cynkowego (ok. 1,5 g).
Po wprowadzeniu całej ilości cynku kolbę dalej ogrzewać do momentu odbarwienia roztworu.
Następnie otrzymaną mieszaninę przesączyć i osad przemyć rozcieńczonym kwasem
solnym (0,5 mol · dm–3).
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną odbarwienia roztworu, i wyjaśnij, w jakim celu otrzymany osad należy przemyć rozcieńczonym kwasem solnym.
Równanie zachodzącej reakcji:
Wyjaśnienie:
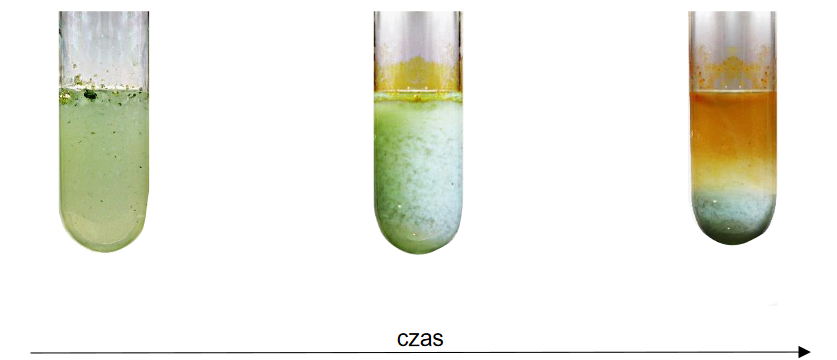
świeżo strącony wodorotlenek miedzi(II) z biuretem – efekty doświadczenia
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Przeprowadzono doświadczenie polegające na dodaniu świeżo strąconego wodorotlenku miedzi(II) do probówki zawierającej wodny roztwór biuretu H2N–CO–NH–CO–NH2.
Spośród poniższych ilustracji wybierz i zaznacz tę, która przedstawia efekt opisanego doświadczenia.

Reakcje w probówkach i zmiana kolorów po dodaniu odczynników
INFORMATOR o egzaminie maturalnym z chemii 22/23
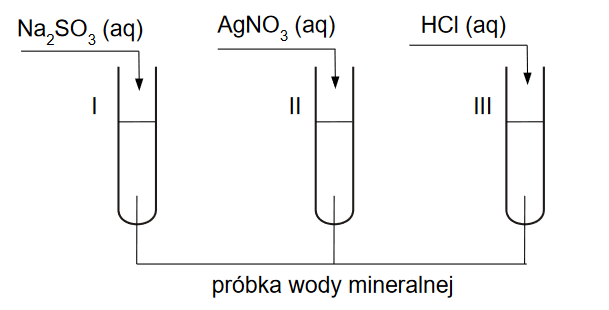
Przeprowadzono doświadczenie, w którym na podstawie zachodzącej reakcji chemicznej można stwierdzić, że wolny chlor jest silniejszym utleniaczem niż wolny brom.
1. Uzupełnij schemat przeprowadzonego doświadczenia – zaznacz po jednym wzorze odczynnika w zestawach I i II.

2. Do probówki zawierającej kilka cm3 bezbarwnego rozpuszczalnika CHCl3 wlano podobną objętość odczynnika, który został wybrany z zestawu I, a następnie zawartość probówki energicznie wstrząsano. Zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 1.). Następnie do probówki dodano odczynnik wybrany z zestawu II, ponownie wstrząsano zawartość probówki i zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 2.).
Zaznacz numer zdjęcia, na którym zilustrowany jest wynik po etapie 1., oraz numer zdjęcia przedstawiającego wynik po etapie 2. doświadczenia.

3. Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia.