przewidywanie kierunku przebiegu reakcji utleniania-redukcji
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
Ze zbioru:
Fe
Ni
Co
Hg
Mn²⁺
Cd²⁺
Cu²⁺
Ag⁺
wybierz drobiny spełniające warunki opisane w poniższej tabeli. Symbole i wzory wybranych drobin wpisz w wyznaczone miejsca.

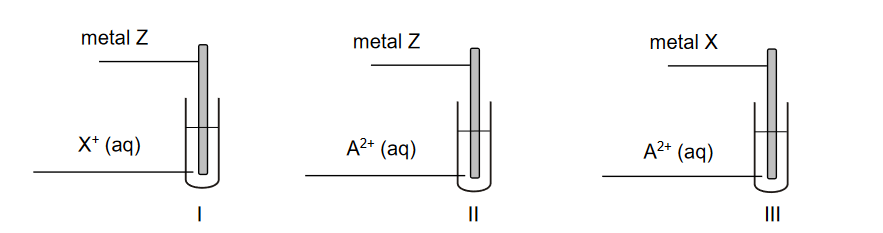
porównywanie aktywności metali
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
Przeprowadzono doświadczenie, którego celem było porównanie aktywności trzech metali oznaczonych umownie literami A, X i Z. Przebieg doświadczenia zilustrowano na poniższym schemacie.
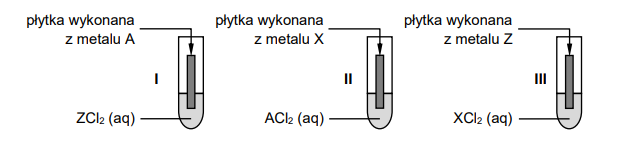
Zmiany zaobserwowane podczas doświadczenia pozwoliły stwierdzić, że aktywność użytych metali rośnie w szeregu A, Z, X.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

przewidywanie kierunku przebiegu reakcji utleniania-redukcji
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
W standardowym półogniwie A ustala się równowaga opisana równaniem:
MnO₄⁻+ 8H⁺ + 5e⁻ ⇄ Mn²⁺+ 4H2O
Po połączeniu tego półogniwa ze standardowym półogniwem B otrzymano ogniwo, którego siła elektromotoryczna (SEM) jest równa 0,971 V.
Napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
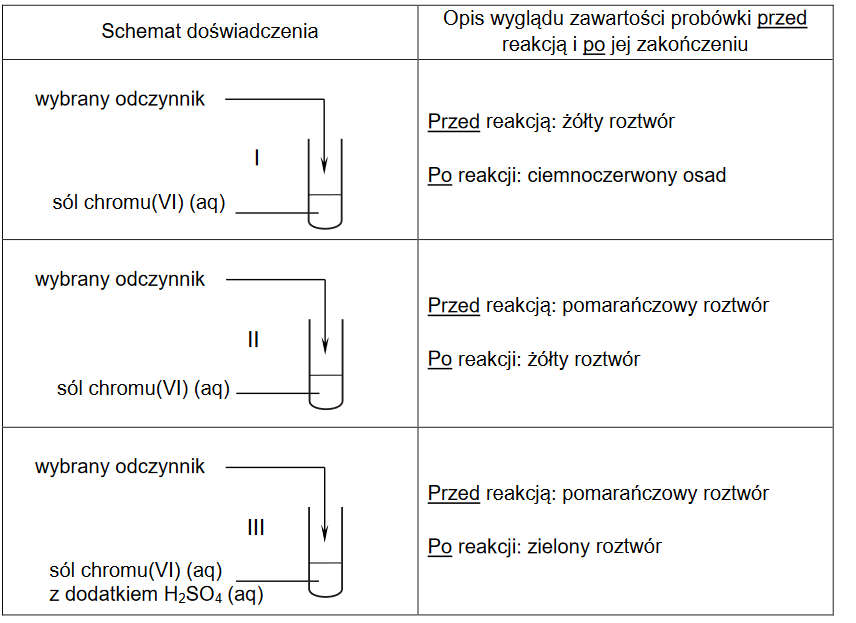
Drobiny zawierające atomy siarki – różne właściwości utleniająco-redukujące
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
Drobiny zawierające atomy siarki różnią się właściwościami utleniająco-redukującymi.
1. Wskaż, spośród wymienionych poniżej, drobinę wykazującą się najsilniejszymi właściwościami utleniającymi (będącą najlepszym utleniaczem):
SO4²⁻ • SO3²⁻ • SO2 • S • S²⁻ • H2S
2. Wskaż, spośród wymienionych poniżej, drobinę wykazującą się najsilniejszymi właściwościami redukującymi (będącą najlepszym reduktorem):
SO4²⁻ • SO3²⁻ • SO2 • S • S²⁻ • H2S
równania reakcji elektrodowych
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
W tabeli przedstawiono równania reakcji elektrodowych i wartości standardowego potencjału redukcji (w temperaturze 25ºC) dla wybranych układów redoks.

1. Na podstawie danych zawartych w powyższej tabeli ustal, czy istnieje możliwość zajścia reakcji zilustrowanych poniższymi schematami. Zaznacz odpowiednie miejsca w tabeli i wyjaśnij swój wybór.

Wyjaśnienie:
2. Napisz w formie jonowej skróconej równanie reakcji zachodzącej z udziałem jonów manganianowych(VII) podczas jednej przemiany wybranej z tabeli. Uzupełnij poniższy schemat. Podkreśl wzór jonów, które w opisanej przemianie pełnią funkcję reduktora.

reakcje REDOX
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Przeprowadzono doświadczenie zilustrowane schematem.
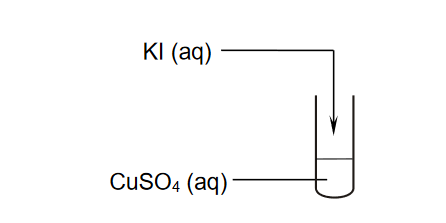
Po zmieszaniu obu roztworów zaszła reakcja utleniania i redukcji, w wyniku której wytrącił się biały osad jodku miedzi(I) i wydzielił się wolny jod.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła po zmieszaniu roztworów KI i CuSO4.
Produkty redukcji związków manganu(VII) w zależności od środowiska
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Wykonano doświadczenie zilustrowane poniższym schematem.
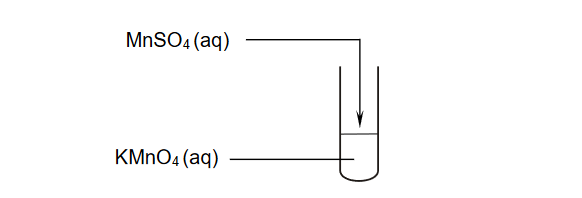
Po zakończeniu reakcji w probówce widoczne były bezbarwny roztwór i brunatny osad.
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo–elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Uwzględnij, że reakcja zachodzi w środowisku obojętnym.
Równanie procesu redukcji:
Równanie procesu utleniania:
obliczenia związane z rozcieńczaniem roztworów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do 1,00 dm3 wody destylowanej wprowadzono 90,0 cm3 wodnego roztworu kwasu azotowego(V) o stężeniu 5,00 % masowych i gęstości równej 1,03 g * cm–3.
Oblicz pH otrzymanego roztworu kwasu azotowego(V). W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworu i wody. Wynik zaokrąglij do drugiego miejsca po przecinku.
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Przygotowano wodne roztwory trzech różnych soli – CH3COONa, NaNO2, NaF – o takim samym stężeniu molowym. Odczyn wszystkich przygotowanych roztworów był zasadowy, ale pH każdego roztworu było inne.
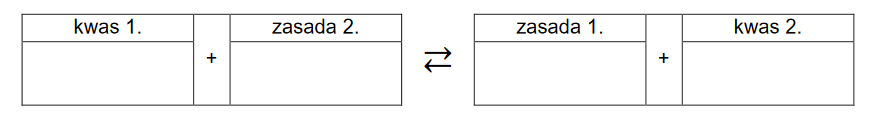
1. Wpisz do poniższego schematu wzory odpowiednich drobin, tak aby powstało równanie potwierdzające zasadowy odczyn roztworu azotanu(III) sodu – zastosuj definicję kwasu i zasady Brønsteda.
2. Napisz wzór lub nazwę tej soli, której wodny roztwór miał najwyższe pH.