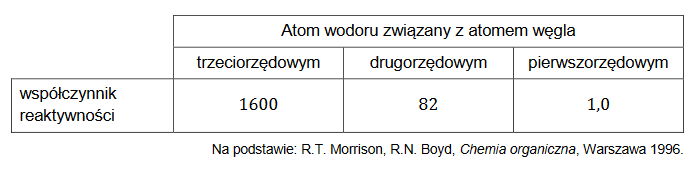
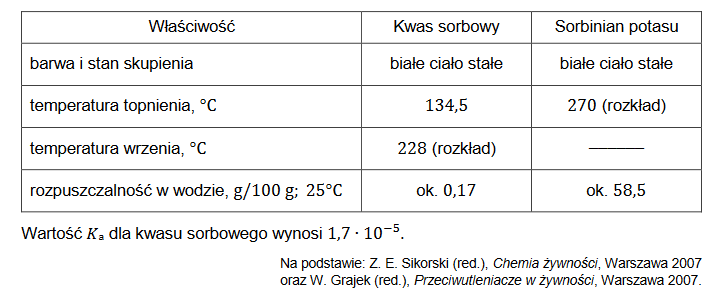
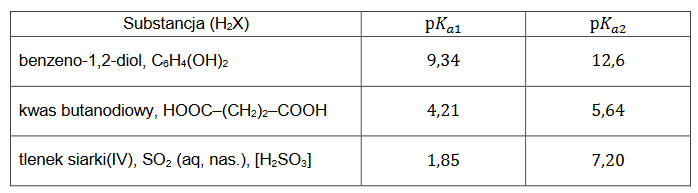
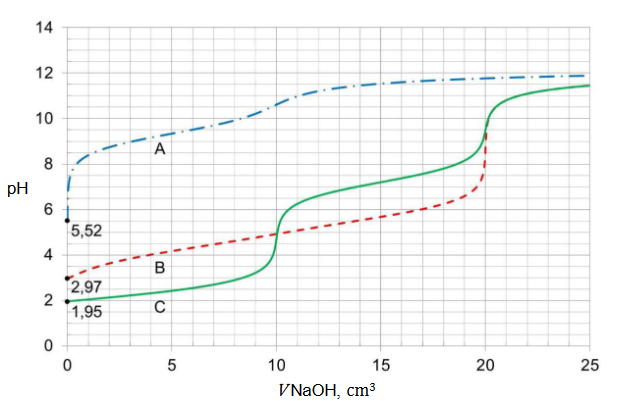
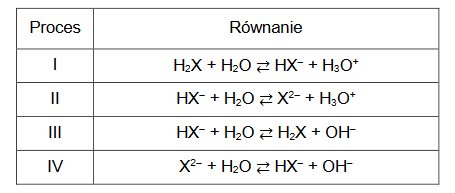
definicja kwasu i zasady Brønsteda
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
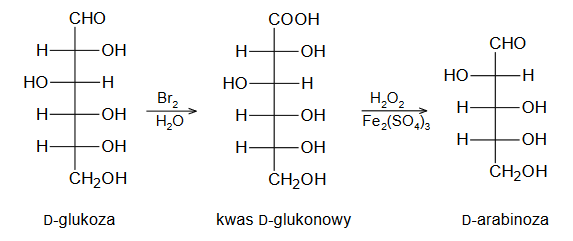
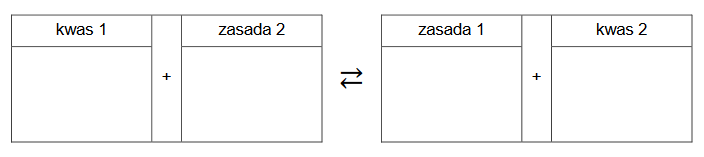
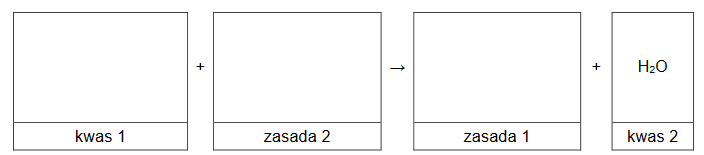
Przeprowadzono reakcje zgodnie ze schematem:
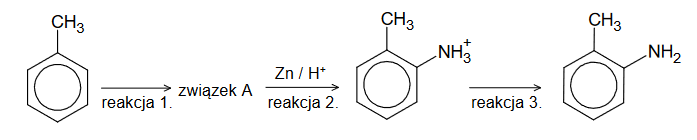
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie reakcji 3. w formie jonowej skróconej. Zastosuj definicję kwasu i zasady Brønsteda.
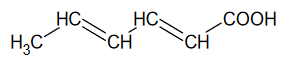
Organiczny związek otrzymany w reakcji 3. zmieszano z bromem (w stosunku molowym 1 : 1) i poddano reakcji w obecności światła.
Narysuj wzór półstrukturalny lub uproszczony organicznego produktu opisanej reakcji i uzupełnij zdanie. Wybierz i zaznacz właściwą odpowiedź spośród podanych w nawiasie.

wzory półstrukturalne (grupowe) fenyloalaniny
Arkusz z chemii rozszerzonej maj 2024 Formuła 2015
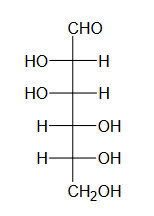
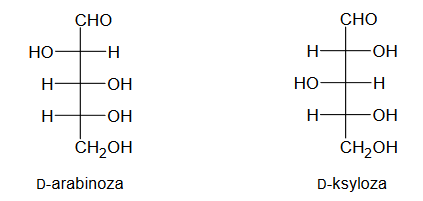
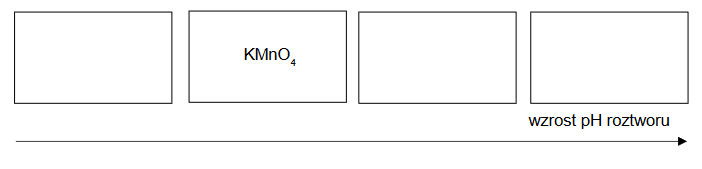
Przeprowadzono doświadczenie zilustrowane na poniższym rysunku:
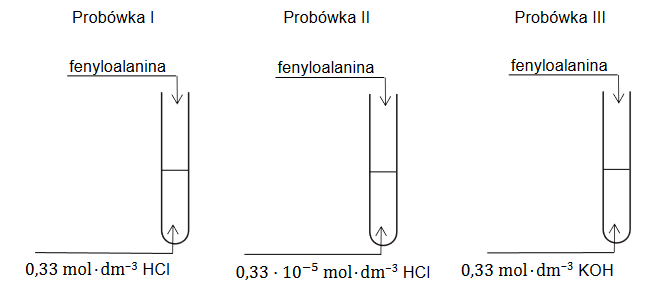
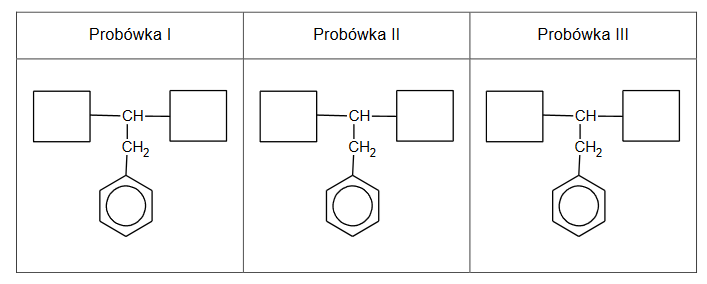
Uzupełnij poniższe schematy, tak aby powstały wzory półstrukturalne (grupowe) fenyloalaniny w postaci, w której ten aminokwas będzie występował w dominującej formie w roztworze w każdej probówce.
stężenia kationów srebra(I)
Arkusz z chemii rozszerzonej maj 2024 Formuła 2023
Zmieszano równe objętości dwóch wodnych roztworów: azotanu(V) srebra(I) o stężeniu c1 = 1 ∙ 10−4 mol ∙ dm−3 i chlorku potasu o stężeniu c2 = 2 ∙ 10−6 mol ∙ dm−3. Podczas doświadczenia utrzymywano temperaturę równą 25 °C.
Uzupełnij poniższe zdania. Wpisz wartość iloczynu stężeń kationów srebra(I) i anionów chlorkowych po zmieszaniu roztworów oraz wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Iloczyn stężeń kationów srebra(I) i anionów chlorkowych w otrzymanej mieszaninie jest równy ….. . Jego wartość jest (mniejsza / większa) od wartości iloczynu rozpuszczalności chlorku srebra(I), dlatego osad tej soli się (nie wytrąci / wytrąci).
reakcje z wodnym roztworem chlorku manganu(II)
Arkusz z chemii rozszerzonej maj 2024 Formuła 2023
W 150 cm3 wodnego roztworu chlorku manganu(II) o stężeniu molowym 𝑐 = 0,678 mol ∙ dm−3 i gęstości 𝑑 = 1,07 g ∙ cm−3 rozpuszczono 6,00 g hydratu tej soli o wzorze MnCl2 ∙ 4H2O.
Na podstawie: Z. Dobkowska, K.M. Pazdro, Szkolny poradnik chemiczny, Warszawa 2020.
Oblicz, jaki procent masy otrzymanego roztworu stanowi masa chlorku manganu(II). Załóż, że objętość roztworu się nie zmieniła. Przyjmij wartości mas molowych: MMnCl2 = 126 g ∙ mol–1 oraz MMnCl2 ∙ 4H2O = 198 g ∙ mol–1.
Chemia nieorganiczna
Arkusz z chemii rozszerzonej maj 2024 Formuła 2023
Jony FeO4 2– mogą powstać podczas reakcji Fe(OH)3 z jonami ClO– w nasyconym roztworze NaOH, zilustrowanej poniższym schematem:
Fe(OH)3 + ClO– + OH– → FeO42– + Cl– + H2O
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji utleniania zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji. Uzupełnij
współczynniki stechiometryczne w poniższym schemacie.
Równanie reakcji utleniania:
…… Fe(OH)3 + …… ClO– + …… OH– → …… FeO42– + …… Cl– + …… H2O
Stężeniowa stała równowagi
Arkusz z chemii rozszerzonej maj 2024 Formuła 2023
Stężeniowa stała równowagi reakcji zilustrowanej poniższym równaniem:
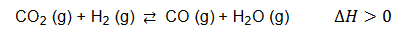
w temperaturze T wynosi 1,0.
1. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

2. W reaktorze o pojemności 1,0 dm3 zmieszano w temperaturze T tlenek węgla(IV) i wodór. Sumaryczna liczba moli tych reagentów była równa 10.
Oblicz początkową liczbę moli tlenku węgla(IV) i początkową liczbę moli wodoru w mieszaninie, jeżeli wiadomo, że do momentu ustalenia się stanu równowagi w temperaturze T przereagowało 60 % wodoru.
rozpuszczalność pewnego hydratu
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 𝟐𝟎 °𝐂 rozpuszczalność hydratu wynosi 𝟏𝟕𝟔 𝐠 w 𝟏𝟎𝟎 𝐠 wody.
Rozpuszczalność soli X
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
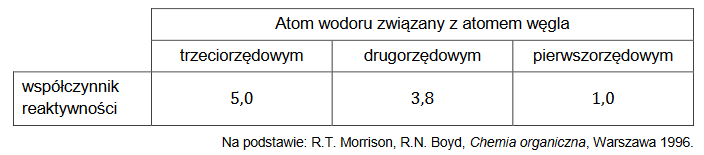
Rozpuszczalność soli X w wodzie wzrasta ze wzrostem temperatury, co pokazują dane zamieszczone w poniższej tabeli.
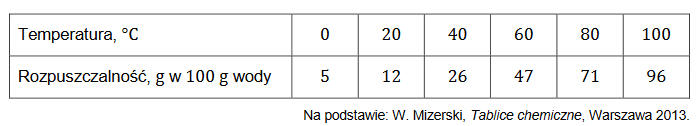
1. Narysuj krzywą rozpuszczalności soli X w zakresie temperatury 𝟎 °𝐂– 𝟏𝟎𝟎 °𝐂 i odczytaj z niego wartość rozpuszczalności w temperaturze 𝟕𝟎 °𝐂. Rozpuszczalność soli X jest funkcją rosnącą w całym podanym zakresie temperatury.
2. Oblicz, ile gramów soli X wykrystalizowało, gdy z 𝟑𝟎𝟎 g roztworu nasyconego w temperaturze 𝟖𝟎 °𝐂 odparowała woda o masie 𝟐𝟓 g. Wynik podaj w zaokrągleniu do jedności.
Bezbarwny wodny roztwór pewnych dwóch soli
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Bezbarwny wodny roztwór dwóch soli może zawierać znaczące ilości następujących jonów:
Br– S2– SO42– NH4+ Mg2+
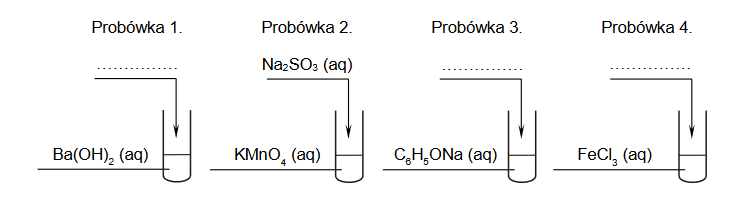
W celu ustalenia składu badanego roztworu pobrano cztery jego próbki i wykonano doświadczenia zilustrowane na poniższym schemacie:
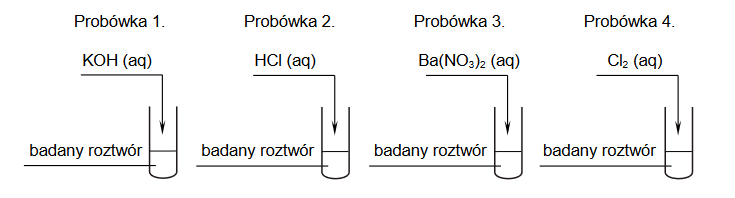
Wszystkie wyniki doświadczenia przedstawiono w tabeli.

1. Napisz wzory sumaryczne dwóch soli, z których przygotowano badany roztwór.
2. Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczenia w probówkach 1. i 4.
Równanie reakcji zachodzącej w probówce 1.:
Równanie reakcji zachodzącej w probówce 4.:
Mieszanie roztworów o różnych stężeniach
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Zmieszano 500 cm3 wodnego roztworu wodorotlenku sodu o nieznanym stężeniu 𝑐 (roztwór A) i 250 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,10 mol * dm^3 (roztwór B). W temperaturze 25°C pH otrzymanego roztworu C wynosiło 12,7.
Oblicz stężenie molowe 𝒄 roztworu A wodorotlenku sodu. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów. Wynik podaj z odpowiednią jednostką.