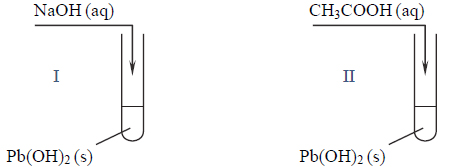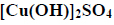Właściwości chlorku wapnia, etanolu, kwasu etanowego, kwasu solnego i zasady potasowej.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Poniżej podano wzory pięciu rozpuszczalnych w wodzie związków chemicznych.


Wypełnij tabelę – wpisz numery, którymi oznaczono wzory wszystkich związków wykazujących podane w tabeli właściwości.
Zmiany pH roztworów po dodaniu różnych związków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Przeprowadzono doświadczenie, w którym do czterech ponumerowanych zlewek I–IV
zawierających po 100 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 3 0,1 mol dm− ⋅ dodano wodne roztwory różnych substancji i wodę destylowaną zgodnie z poniższym rysunkiem.
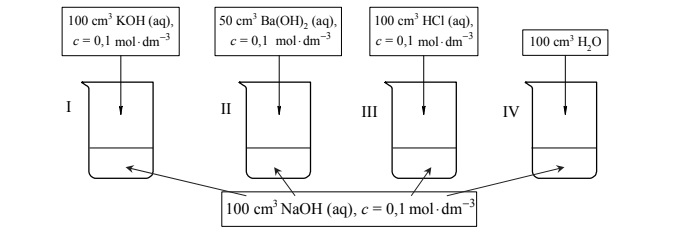

Uzupełnij poniższą tabelę – podaj wartość pH wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol · dm–3 oraz wpisz numery zlewek, w których pH otrzymanego roztworu było niższe albo było wyższe od pH roztworu wyjściowego, albo nie uległo zmianie w czasie doświadczenia.
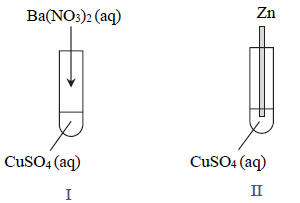
Roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI)
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
W zlewce umieszczono świeżo przygotowany roztwór wodny trzech soli sodu: chromianu(VI), ortofosforanu(V) i siarczanu(VI).
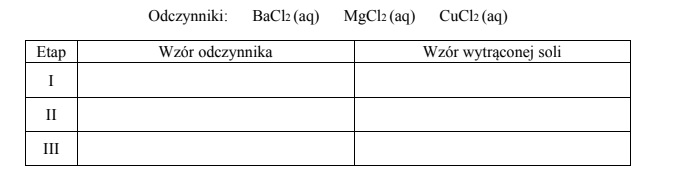
Zaplanuj doświadczenie, które w następujących po sobie etapach I–III umożliwi wydzielenie z opisanego roztworu – przez wytrącenie osadów soli – kolejno wszystkich anionów kwasów tlenowych. Napisz w odpowiedniej kolejności wzory odczynników oraz wzory wytrąconych soli.
Pary kwas-zasada. Teoria Bronsteda.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Dane są wzory sześciu cząsteczek i jonów:
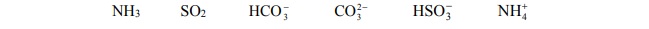
Spośród wymienionych powyżej wzorów wybierz i wpisz do tabeli wzory tych drobin,
które zgodnie z teorią Brønsteda stanowią sprzężone pary kwas–zasada.

Określenie zawartości probówki zawierającej wodny roztwór NH4Cl
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W trzech nieopisanych probówkach znajdują się wodne roztwory następujących soli: BaCl2,
NH4Cl oraz NaCl. W każdej probówce znajduje się roztwór tylko jednej soli.
Z poniższej listy wybierz dwa odczynniki, których zastosowanie pozwoli jednoznacznie
określić zawartość każdej probówki.
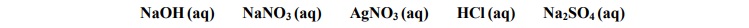
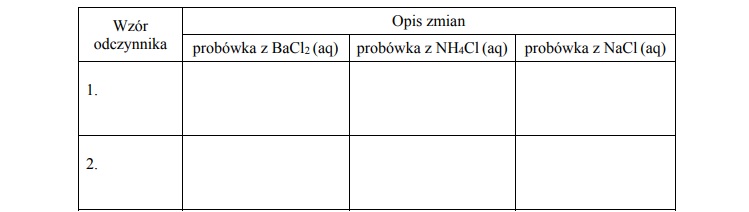
Wypełnij poniższą tabelę – wpisz wzory wybranych odczynników oraz opisz zmiany
możliwe do zaobserwowania (lub zaznacz brak zmian), zachodzące po dodaniu
wybranych odczynników do probówek z wodnymi roztworami soli.
Napisz w formie jonowej skróconej równanie reakcji, która pozwoliła na jednoznaczne
określenie zawartości probówki zawierającej wodny roztwór NH4Cl.
Charakter chemiczny wodorotlenku niklu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.

Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu
wodorotlenku sodu.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku
niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy,
obojętny, amfoteryczny) wodorotlenku niklu(II).
Równanie reakcji:
Charakter chemiczny wodorotlenku niklu(II):
Reakcje procesu utleniania i redukcji soli niklu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.

Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu
przebiega w środowisku wodnym zgodnie ze schematem:
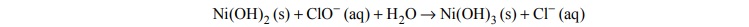
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych
elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania
zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza
w tej reakcji.
Równanie procesu redukcji:
Równanie procesu utleniania:
Stosunek molowy n reduktora : n utleniacza =
Wodorotlenek niklu oraz sole niklu. Zmiany barw.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod
działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się
w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek
przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa,
Warszawa 2001.
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór
wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu, zgodnie ze
schematem:
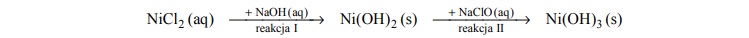
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po
reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.

Reakcja złota z wodą królewską.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Złoto jest doskonale kowalnym żółtym metalem o silnym połysku. W czystej postaci jest
stosunkowo miękkie, więc w wyrobach jubilerskich stosuje się stopy złota z innymi metalami,
np. srebrem lub miedzią. Zawartość czystego złota w tych wyrobach podaje się w jednostkach
zwanych karatami. Jeden karat odpowiada 1/24 zawartości masowej złota w stopie, co oznacza,
że czyste złoto jest 24-karatowe. Złoto jest metalem szlachetnym, więc trudno ulega reakcjom
chemicznym. Roztwarza się w wodzie królewskiej, przy czym powstaje m.in. chlorkowy
kompleks złota(III), co ilustruje poniższe równanie:

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest
prawdziwa, albo F – jeśli jest fałszywa.

Różnice w przebiegu doświadczenia z udziałem siarczanu(IV) sodu i azotanu(V) sodu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że wodny roztwór
siarczanu(IV) sodu wprowadzono do probówki I, a wodny roztwór azotanu(V) sodu
– do probówki II.
Uzupełnij schemat doświadczenia: podkreśl nazwę odczynnika, który – po dodaniu do
niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi
zaobserwowanie różnic w przebiegu doświadczenia z udziałem siarczanu(IV) sodu
i azotanu(V) sodu.

Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia (lub zaznacz brak
zmian), pozwalające na potwierdzenie, że do probówki I wprowadzono roztwór
siarczanu(IV) sodu, a do probówki II – roztwór azotanu(V) sodu.
Probówka I:
Probówka II: