zawartość węglanu wapnia w różnych mieszaninach
Arkusz z chemii rozszerzonej maj 2023 stara formuła
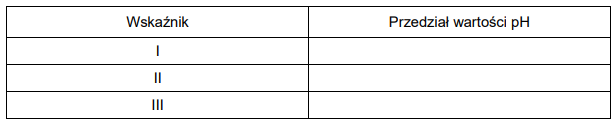
W celu określenia zawartości węglanu wapnia w mieszaninie dwóch soli zawierającej również węglan magnezu próbkę tej mieszaniny o masie 2,84 g roztworzono w kwasie. Podczas analizy przebiegły reakcje chemiczne:
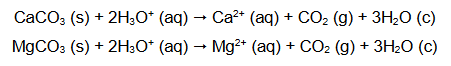
W wyniku zachodzących reakcji otrzymano 672 cm3 tlenku węgla(IV) w przeliczeniu na warunki normalne.
Oblicz wyrażoną w procentach masowych zawartość CaCO3 w badanej próbce mieszaniny.
Uzupełnianie współczynników stechiometrycznych
Arkusz z chemii rozszerzonej maj 2023 stara formuła
W środowisku wodnym aniony tiosiarczanowe reagują z chlorem zgodnie ze schematem:
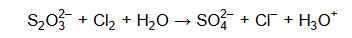
Podczas tej reakcji aniony tiosiarczanowe ulegają utlenieniu, które przebiega według schematu:
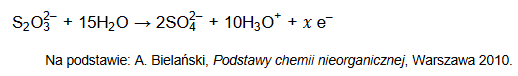
Uzupełnij współczynniki stechiometryczne w poniższym schemacie reakcji.
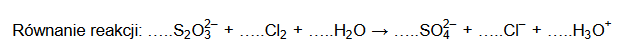
Reakcja hydratacji
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:

Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
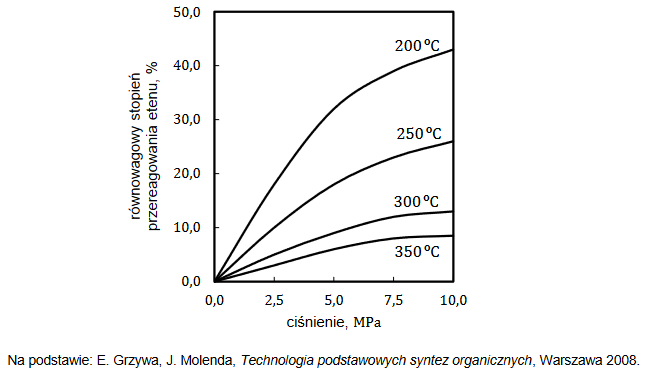
1. Wyjaśnij, dlaczego w danej temperaturze równowagowy stopień przereagowania etenu w opisanej reakcji jest tym większy, im wyższe jest ciśnienie, pod którym prowadzona jest reakcja.
2. Rozstrzygnij, czy reakcja hydratacji etenu jest procesem endo– czy egzotermicznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
stan równowagi dynamicznej i stała równowagi
Arkusz diagnostyczny z chemii 2022 grudzień
W wysokiej temperaturze tlenki żelaza można zredukować wodorem do metalicznego żelaza. Redukcja tlenku Fe₃O₄ przebiega zgodnie z równaniem:
Fe₃O₄(s) + 4H₂(g) ⇄ 3Fe(s) + 4H₂O(g)
Z reaktora o pojemności 8,0 dm3, zawierającego 420 g tlenku Fe₃O₄, odpompowano powietrze i wprowadzono 6,0 g wodoru. Zawartość reaktora ogrzano do temperatury 𝑇, w której stała równowagi powyższej reakcji wynosi 0,20.
Oblicz stężenie pary wodnej w reaktorze po ustaleniu się stanu równowagi oraz masę otrzymanego żelaza.
obliczenia w reaktorze
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do reaktora o pojemności 1,0 dm3 wprowadzono pewną liczbę moli substancji A oraz pewną liczbę moli substancji B. Reaktor zamknięto i zainicjowano reakcję chemiczną, która przebiegała w stałej temperaturze T zgodnie z równaniem:
A (g) + B (g) ⇄ C (g) + D (g)
Do momentu ustalenia stanu równowagi przereagowało 20 % substancji A. W tych warunkach stężeniowa stała równowagi opisanej reakcji jest równa 2,0.
Oblicz, jaki procent liczby moli wyjściowej mieszaniny stanowiła substancja A.
Obliczenia z reaktora
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Do reaktora wprowadzono próbkę N2O4 o masie równej 4,14 g. W reaktorze utrzymywano stałe ciśnienie równe 1000 hPa i stałą temperaturę 298 K, natomiast zmianie mogła ulegać pojemność. W warunkach prowadzenia eksperymentu ustaliła się równowaga chemiczna opisana równaniem:
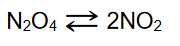
Objętość mieszaniny obu tlenków, po ustaleniu się stanu równowagi, była równa 1,32 dm3.
Oblicz stężeniową stałą równowagi Kc przemiany w opisanych warunkach. Stała gazowa R = 83,14 hPa · dm3 · mol–1 · K–1. Przyjmij, że NO2 i N2O4 są gazami doskonałymi.
Równanie kinetyczne reakcji – obliczenia
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Równanie kinetyczne reakcji opisanej równaniem:
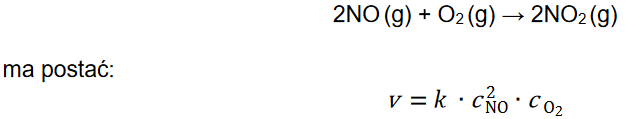
Szybkość reakcji chemicznej v, wyrażona w jednostce: mol *dm−3 * s−1, zależy od stężeń molowych substratów reakcji oraz od stałej szybkości reakcji 𝑘 – współczynnika charakterystycznego dla danej reakcji. Stała szybkości reakcji zależy od temperatury, a nie zależy od stężenia substratów.
1. Napisz jednostkę stałej szybkości reakcji 𝒌 w równaniu kinetycznym opisanej reakcji.
2. W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole tlenu. Podczas reakcji utrzymywano stałą temperaturę T.
Oblicz, ile razy zmaleje szybkość opisanej reakcji w stosunku do szybkości
początkowej, w momencie, w którym stężenie tlenu zmniejszy się o 1 mol * dm−3.
standardowe półogniwo
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
W standardowym półogniwie A ustala się równowaga opisana równaniem:
MnO4− + 8H+ + 5e− ⇄ Mn2+ + 4H2O
Po połączeniu tego półogniwa ze standardowym półogniwem B otrzymano ogniwo, którego siła elektromotoryczna (SEM) jest równa 0,971 V.
Napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
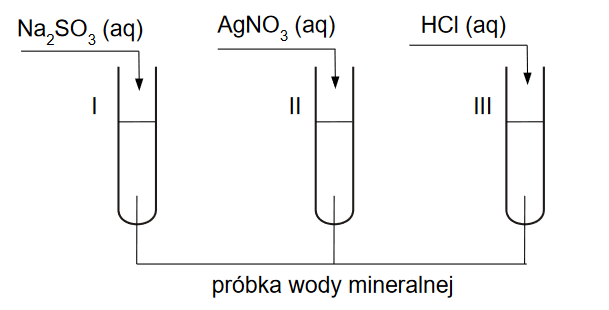
Reakcje w probówkach i zmiana kolorów po dodaniu odczynników
INFORMATOR o egzaminie maturalnym z chemii 22/23
Przeprowadzono doświadczenie, w którym na podstawie zachodzącej reakcji chemicznej można stwierdzić, że wolny chlor jest silniejszym utleniaczem niż wolny brom.
1. Uzupełnij schemat przeprowadzonego doświadczenia – zaznacz po jednym wzorze odczynnika w zestawach I i II.

2. Do probówki zawierającej kilka cm3 bezbarwnego rozpuszczalnika CHCl3 wlano podobną objętość odczynnika, który został wybrany z zestawu I, a następnie zawartość probówki energicznie wstrząsano. Zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 1.). Następnie do probówki dodano odczynnik wybrany z zestawu II, ponownie wstrząsano zawartość probówki i zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 2.).
Zaznacz numer zdjęcia, na którym zilustrowany jest wynik po etapie 1., oraz numer zdjęcia przedstawiającego wynik po etapie 2. doświadczenia.

3. Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia.
nawóz sztuczny – superfosfat
INFORMATOR o egzaminie maturalnym z chemii 22/23
Superfosfat jest nawozem sztucznym zawierającym diwodoroortofosforan(V) wapnia (Ca(H₂PO₄)₂), siarczan(VI) wapnia (CaSO₄) oraz zanieczyszczenia niezawierające wapnia i siarki. W superfosfacie zawartość procentowa siarki wynosi 11,9%, a zawartość procentowa wapnia jest równa 22,2%.
Oblicz w procentach masowych zawartość diwodoroortofosforanu(V) wapnia w superfosfacie.