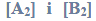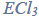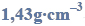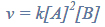W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W reaktorze o stałej pojemności znajdowały się tlenek węgla(II) i para wodna zmieszane
w stosunku masowym 1 : 1, a sumaryczna liczba moli tych reagentów była równa 20.
Stężeniowa stała równowagi reakcji
CO (g) + H2O (g) ⇄ CO2 (g) + H2 (g)
w warunkach prowadzenia procesu wynosi 1.
Oblicz, ile moli wodoru znajdowało się w reaktorze po osiągnięciu stanu równowagi przez układ.
W zamkniętym reaktorze o pojemności 1 dm3 znajdowały się gazowe substancje A i B…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W zamkniętym reaktorze o pojemności 1 dm3 znajdowały się gazowe substancje A i B
zmieszane w stosunku stechiometrycznym. Reagenty ogrzano do temperatury T i zainicjowano reakcję przebiegającą zgodnie z poniższym schematem.
A (g) + 2B(g) ⇄ 3C(g) + D (g)
Przez jedną minutę, co 10 sekund, oznaczano liczbę moli substancji A
w mieszaninie reakcyjnej. Wyniki zestawiono w poniższej tabeli.
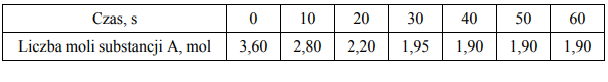
Uzupełnij poniższą tabelę, a następnie narysuj wykres przedstawiający zależność stężenia substancji C od czasu trwania reakcji, czyli w przedziale <0s, 60s> .
Oblicz stopień dysocjacji kwasu HX w tym roztworze.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX+H2O ⇄ + − H3O + X
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).
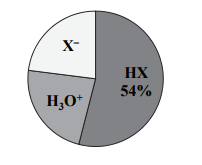
Oblicz stopień dysocjacji kwasu HX w tym roztworze.
Oblicz objętość kwasu solnego o stężeniu 0,1 mol·dm−3…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Reakcja kwasu solnego z wodorotlenkiem potasu przebiega zgodnie z równaniem
HCl + KOH → KCl + H2O
Oblicz objętość kwasu solnego o stężeniu 0,1 mol·dm−3, jaką należy dodać do 300 cm3 wodnego roztworu wodorotlenku potasu o stężeniu 0,2 mol·dm−3, aby otrzymany roztwór miał pH = 13. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI)…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI) na stałe chlorki, np. w reakcjach opisanych równaniami:
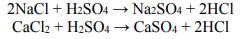
Sporządzono 150 g mieszaniny zawierającej tylko NaCl i CaCl2, na którą podziałano stężonym kwasem siarkowym(VI) użytym w nadmiarze. W wyniku tego procesu otrzymano 58,24 dm3 chlorowodoru (w warunkach normalnych).
Oblicz skład wyjściowej mieszaniny w procentach masowych. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Mieszanina tlenku węgla(II) i wodoru to gaz syntezowy, który stosuje się do otrzymywania wielu związków organicznych.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Mieszanina tlenku węgla(II) i wodoru to gaz syntezowy, który stosuje się do otrzymywania wielu związków organicznych. Proces produkcji metanolu z gazu syntezowego zilustrowano poniższym równaniem.
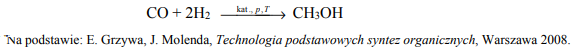
Oblicz, ile m3 gazu syntezowego odmierzonego w warunkach normalnych potrzeba do otrzymania 2 · 1025 cząsteczek metanolu, jeżeli reakcja przebiega z wydajnością równą 70%. Przyjmij, że stosunek molowy CO H2 n : n jest równy 1 : 2. Wynik zaokrąglij do jednego miejsca po przecinku.
Witaminę C otrzymano w czteroetapowym procesie. Poszczególne etapy miały wydajność:
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Witaminę C otrzymano w czteroetapowym procesie. Poszczególne etapy miały wydajność:
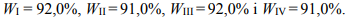
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Wybierz i zaznacz poprawne dokończenie zdania.
Całkowita wydajność procesu otrzymywania witaminy C była równa
A. 91,5%
B. 90,0%
C. 80,0%
D. 70,1%
Próbkę X pewnego preparatu, którego głównym składnikiem jest witamina C, rozpuszczono w wodzie, w wyniku czego otrzymano 100,0 cm3roztworu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Zawartość kwasu askorbinowego w próbce wyznacza się na podstawie stechiometrii jego
reakcji z jodem. Do roztworu zawierającego nieznaną ilość kwasu askorbinowego i niewielką ilość skrobi dodaje się kroplami roztwór jodu w roztworze jodku potasu. Stężenie roztworu jodu musi być dokładnie znane, a jego objętość – mierzona. Mówimy, że roztwór kwasu askorbinowego miareczkuje się roztworem jodu. Dopóki kwas askorbinowy jest obecny w roztworze, zachodzi reakcja, którą można w uproszczeniu opisać równaniem:
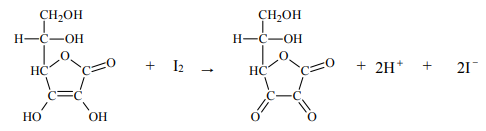
Gdy cały kwas askorbinowy przereaguje, jod dostarczony w nadmiarowej kropli poskutkuje zabarwieniem skrobi. W tym momencie kończy się miareczkowanie, co oznacza, że osiągnięto punkt końcowy i należy odczytać objętość zużytego roztworu jodu. Gdy zna się jego stężenie, można obliczyć, ile kwasu askorbinowego zawierała próbka.
Próbkę X pewnego preparatu, którego głównym składnikiem jest witamina C, rozpuszczono w wodzie, w wyniku czego otrzymano 100,0 cm3
roztworu. Następnie pobrano 10,0 cm3 tego roztworu, przeniesiono do kolby i miareczkowano roztworem jodu o stężeniu 0,052 3 mol dm− ⋅ . Stwierdzono, że punkt końcowy miareczkowania został osiągnięty po dodaniu 10,8 cm3 roztworu jodu.
Oblicz w miligramach zawartość witaminy C w próbce X, jeśli wiadomo, że pozostałe składniki preparatu nie reagują z jodem. Przyjmij, że masa molowa witaminy C jest równa M = 176 g·mol–1.