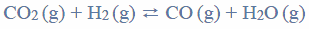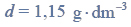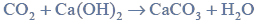Reakcja syntezy amoniaku.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
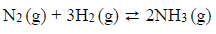
W mieszaninie wodoru i azotu użytej do syntezy amoniaku zawartość wodoru wyrażona w procentach objętościowych jest równa 75%. Wydajność reakcji syntezy amoniaku przeprowadzonej w temperaturze T i pod ciśnieniem p jest równa 93%.
Oblicz wyrażoną w procentach objętościowych zawartość amoniaku w mieszaninie poreakcyjnej.
Próbka węglanu wapnia.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Próbkę czystego węglanu wapnia o masie m prażono w otwartym naczyniu. Przebiegła wtedy reakcja zilustrowana równaniem:
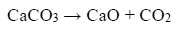
Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowała się mieszanina substancji stałych o masie 18,0 gramów. Ustalono, że w tej mieszaninie zawartość węglanu wapnia wyrażona w procentach masowych jest równa 57,5%.
Oblicz masę m próbki węglanu wapnia poddanej prażeniu.
Hydroliza anionowa roztworu węglanu.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Węglany w roztworach wodnych ulegają hydrolizie anionowej, która polega na dysocjacji zasadowej anionu, zgodnie z równaniem:
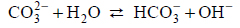
Drugi etap hydrolizy polegający na reakcji jonu
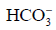
z wodą zachodzi w tak małym stopniu, że nie ma wpływu na pH roztworu.
W temperaturze 25 °C wodny roztwór węglanu potasu o stężeniu
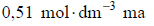
ma pH równe 12,0.
Oblicz stałą dysocjacji zasadowej (stałą równowagi reakcji hydrolizy) anionu węglanowego. Uwzględnij fakt, że w wyrażeniu na stałą dysocjacji zasadowej anionu węglanowego pomija się stężenie wody.
Na próbkę stopu miedzi z cynkiem o masie 4 g…
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Na próbkę stopu miedzi z cynkiem o masie 4,00 g podziałano 200 cm3 kwasu solnego o stężeniu
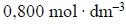
Przebiegła wtedy reakcja opisana równaniem:
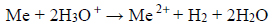
Roztwór otrzymany po reakcji rozcieńczono wodą do objętości 250 cm3. Stężenie jonów wodorowych w tym roztworze było równe
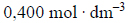
Oblicz, ile gramów miedzi znajdowało się w opisanej próbce stopu. Wynik końcowy zaokrąglij do drugiego miejsca po przecinku.
Wskazówki:
- Miedź jako metal szlachetny nie będzie reagować z kwasem beztlenowym.
- Cynk reaguje z kwasem beztlenowym jako jedyny składnik stopu.
- Reakcję w formie jonowej można zapisać w formie cząsteczkowej dla ułatwienia.
- W reakcji metalu aktywnego (cynk) z kwasem beztlenowym wydzieli się wodór.
Reakcje metali z kwasami – LINK
Identyfikacja wzoru monochloropochodnej.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Podczas ogrzewania próbki monochloropochodnej pewnego nasyconego węglowodoru o budowie łańcuchowej z nadmiarem wodnego roztworu wodorotlenku sodu przebiegła reakcja zilustrowana schematem:
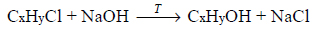
Do otrzymanej mieszaniny poreakcyjnej dodano najpierw wodny roztwór kwasu azotowego(V) w celu zobojętnienia, a następnie – nadmiar wodnego roztworu azotanu(V) srebra. W wyniku reakcji opisanej równaniem:

wytrącił się osad, który odsączono i wysuszono. Masa próbki monochloropochodnej była równa 0,314 g, a w wyniku opisanych przemian otrzymano 0,574 g stałego chlorku srebra.
Wykonaj obliczenia i zaproponuj jeden wzór półstrukturalny (grupowy) chloropochodnej tego węglowodoru.