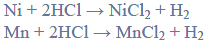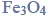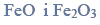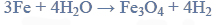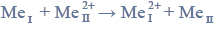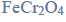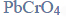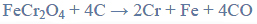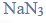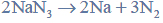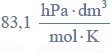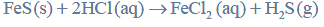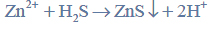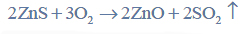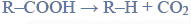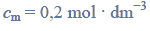Otrzymywanie kwasu etanowego.
Zbiór zadań maturalnych z chemii CKE 2015
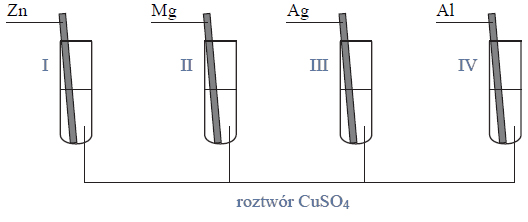
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
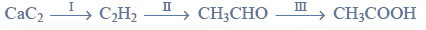
Wydajności kolejnych przemian (etapów) były odpowiednio równe: W I = 85%, W II = 80%, W III = 95%.
Oblicz całkowitą wydajność opisanego procesu.
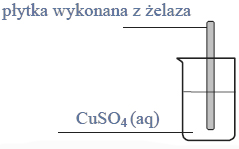
Reakcja karbidu.
Zbiór zadań maturalnych z chemii CKE 2015
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
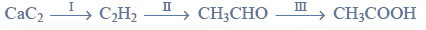
Wydajności kolejnych przemian (etapów) były odpowiednio równe: W I = 85%, W II = 80%, W III = 95%.
Oblicz, ile decymetrów sześciennych związku organicznego powstanie w wyniku przemiany I (warunki normalne), jeżeli do reakcji użyto 1 kg zanieczyszczonego karbidu. Pamiętaj, że przemiana ta zachodzi z wydajnością równą 85%.
Metoda otrzymywania roztworu kwasu octowego.
Zbiór zadań maturalnych z chemii CKE 2015
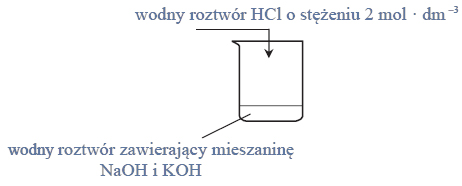
W pracowni chemicznej znajduje się roztwór kwasu octowego o stężeniu 10% masowych. Zaprojektuj sposób postępowania, który pozwoli z tego roztworu otrzymać roztwór kwasu octowego o stężeniu 6% masowych. Dysponujesz: zlewką, w której znajduje się 200 g roztworu kwasu octowego o stężeniu 10% masowych, zlewką, w której znajduje się 500 g wody destylowanej, pustą zlewką o pojemności 0,5 dm3, szklaną bagietką oraz wagą laboratoryjną.
Zapisz odpowiednie obliczenia, które należy wykonać, aby otrzymać roztwór kwasu octowego o stężeniu 6% masowych z roztworu tego kwasu o stężeniu 10% masowych.
Obliczanie stężenia molowego roztworu kwasu octowego
Zbiór zadań maturalnych z chemii CKE 2015
W pracowni chemicznej znajduje się roztwór kwasu octowego o stężeniu 10% masowych. Zaprojektuj sposób postępowania, który pozwoli z tego roztworu otrzymać roztwór kwasu octowego o stężeniu 6% masowych. Dysponujesz: zlewką, w której znajduje się 200 g roztworu kwasu octowego o stężeniu 10% masowych, zlewką, w której znajduje się 500 g wody destylowanej, pustą zlewką o pojemności 0,5 dm3, szklaną bagietką oraz wagą laboratoryjną.
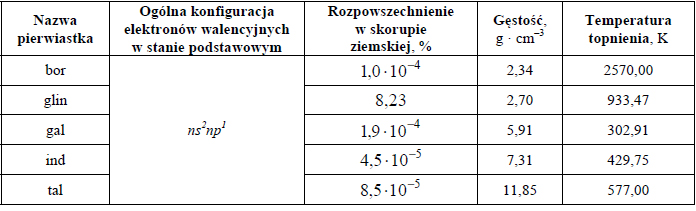
Oblicz stężenie molowe roztworu kwasu octowego (o stężeniu 10,00% masowych) znajdującego się w zlewce, jeżeli gęstość tego roztworu wynosi

oraz stężenie molowe roztworu kwasu octowego (o stężeniu 6,00% masowych) otrzymanego po rozcieńczeniu, jeżeli jego gęstość wynosi
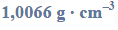
Źródło: J. Sawicka i inni, Tablice Chemiczne, Gdańsk 2004, s. 224.