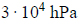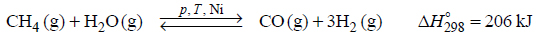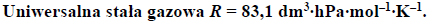Oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu, który ma mniejszą masę atomową.

Zawartość procentowa tlenu w mieszaninie.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
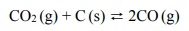
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
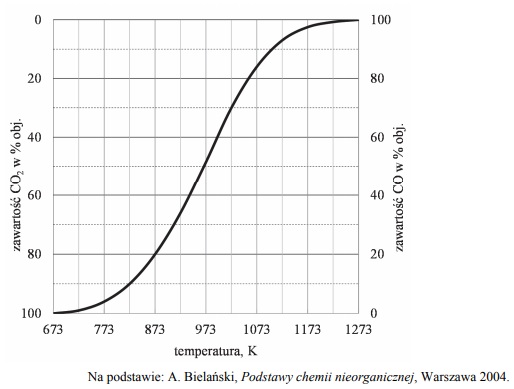
Oblicz wyrażoną w procentach masowych zawartość tlenu, wchodzącego w skład CO2 i CO, w pozostającej w równowadze mieszaninie tych związków z węglem w temperaturze 873 K i pod ciśnieniem 1013 hPa. Możesz przyjąć, że sumaryczna liczba moli gazowego substratu i gazowego produktu reakcji jest równa 1. W opisanych warunkach 1 mol gazu zajmuje objętość 71,6 dm3.

Stała stężeniowa równowagi.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Dwa gazy A i B zmieszane w stosunku molowym AB: 1:4 nn = zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
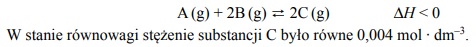
Oblicz stężeniową stałą równowagi (Kc) opisanej reakcji w temperaturze T.

Izotopy miedzi.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Masa atomowa izotopu jest w przybliżeniu równa jego liczbie masowej A. Miedź występuje w przyrodzie w postaci dwóch trwałych izotopów. Skład izotopowy miedzi (w zaokrągleniu do jedności) przedstawiono w poniższej tabeli.
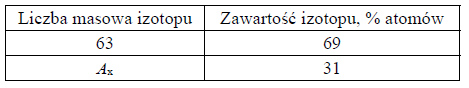
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
Wykonaj obliczenia i podaj liczbę masową Ax drugiego naturalnego izotopu miedzi. Przyjmij, że średnia masa atomowa miedzi jest równa 63,55 u.
Połowiczny rozpad próbki chlorku sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Próbka chlorku sodu zawierała 0,25 milimola promieniotwórczego nuklidu
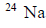
W czasie 30 godzin rozpadowi uległo 75 % tego nuklidu.
1. Oblicz masę sodu 24Na, który uległ w tym czasie rozpadowi. Przyjmij, że masa atomowa tego nuklidu jest równa jego liczbie masowej.
2. Określ okres półtrwania (τ1/2) tego izotopu.
Obliczanie stałej stężeniowej reakcji.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W zamkniętym naczyniu pomiędzy substancjami X, Y oraz Z, które w temperaturze T i pod ciśnieniem p są gazami, ustala się stan równowagi chemicznej.
Zmianę liczby moli reagentów X, Y oraz Z w trakcie procesu przedstawia poniższy wykres.
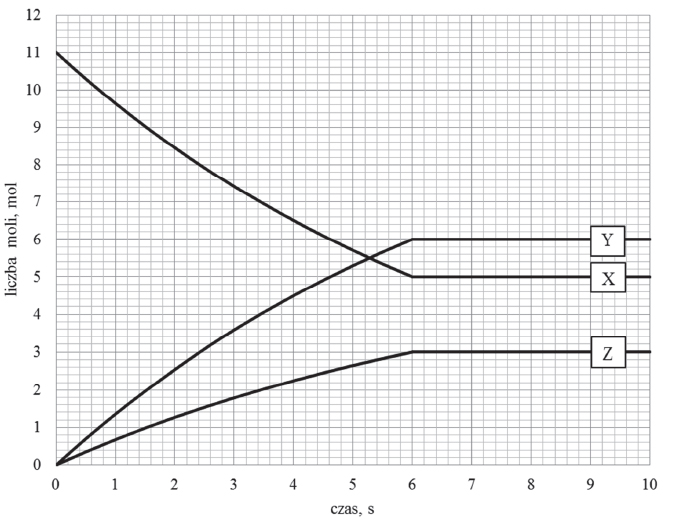
Reakcja, dla której zmianę liczby moli reagentów przedstawiono na wykresie, przebiegała w reaktorze o pojemności 4 dm3. W temperaturze T i pod ciśnieniem p do reaktora wprowadzono substrat reakcji X i badano zmiany liczby moli reagentów w trakcie trwania procesu prowadzącego do ustalenia stanu równowagi dynamicznej.
Oblicz stężeniową stałą równowagi Kc opisanego procesu w temperaturze T.
Blaszka miedziana zanurzona w roztworze srebra.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Blaszkę miedzianą o masie 4,0 g zanurzono w nasyconym wodnym roztworze azotanu(V) srebra. Przebiegała reakcja opisana równaniem:
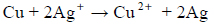
Po pewnym czasie płytkę wyjęto i osuszono. Masa płytki wynosiła 4,3 g.
Oblicz masę srebra osadzonego na płytce.
Elektroliza wodnego roztworu siarczanu (VI) potasu
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Przez 161 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) potasu prądem stałym o natężeniu 1,49 ampera. Zastosowano elektrody platynowe. Stwierdzono, że podczas elektrolizy zaszły procesy elektrodowe rozkładu wody.
1. Napisz równanie procesu zachodzącego podczas elektrolizy tej soli na katodzie oraz równanie procesu przebiegającego podczas elektrolizy tej soli na anodzie.
2. Oblicz, ile gramów gazowego produktu wydzieliło się na katodzie podczas tego procesu, jeżeli przebiegał on ze 100% wydajnością prądową.
Hydrat tiosiarczanu sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W wyniku reakcji chemicznej roztworu siarczanu(IV) sodu z siarką otrzymuje się wodny roztwór tiosiarczanu sodu. Proces ten można opisać równaniem:
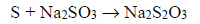
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W wodzie rozpuszczono 6,3 g
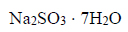
i dodano nadmiar siarki. Otrzymaną mieszaninę gotowano przez pewien czas, po czym przesączono w celu usunięcia nadmiaru siarki. Z przesączu po ochłodzeniu otrzymano 5,2 g kryształów uwodnionego tiosiarczanu sodu. Ten związek, poddany odwodnieniu pod obniżonym ciśnieniem, zmniejszył swoją masę o 36,3%
Wykonaj odpowiednie obliczenia i podaj wzór hydratu tiosiarczanu sodu, który otrzymano z mieszaniny poreakcyjnej w wyniku krystalizacji.
Krystalizacja tiosiarczanu sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W wyniku reakcji chemicznej roztworu siarczanu(IV) sodu z siarką otrzymuje się wodny roztwór tiosiarczanu sodu. Proces ten można opisać równaniem:
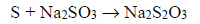
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W wodzie rozpuszczono 6,3 g
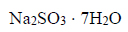
i dodano nadmiar siarki. Otrzymaną mieszaninę gotowano przez pewien czas, po czym przesączono w celu usunięcia nadmiaru siarki. Z przesączu po ochłodzeniu otrzymano 5,2 g kryształów uwodnionego tiosiarczanu sodu. Ten związek, poddany odwodnieniu pod obniżonym ciśnieniem, zmniejszył swoją masę o 36,3%.
Załóż, że synteza tiosiarczanu sodu zachodzi z wydajnością 100%, i oblicz, jaka była wydajność procesu krystalizacji.
Hydroliza anionowa kwasu azotowego (III)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Azotany(III) ulegają w roztworach wodnych odwracalnej reakcji hydrolizy anionowej zgodnie z równaniem:
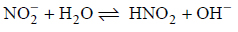
Oblicz stałą równowagi tej reakcji w temperaturze 25 °C. W obliczeniach wykorzystaj wartość stałej dysocjacji Ka kwasu azotowego(III) oraz iloczynu jonowego wody Kw w tej temperaturze. Przyjmij, że stężenie wody jest stałe.
Stan równowagi, wykres.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W zamkniętym naczyniu pomiędzy substancjami X, Y oraz Z, które w temperaturze T i pod ciśnieniem p są gazami, ustala się stan równowagi chemicznej.
Zmianę liczby moli reagentów X, Y oraz Z w trakcie procesu przedstawia poniższy wykres.
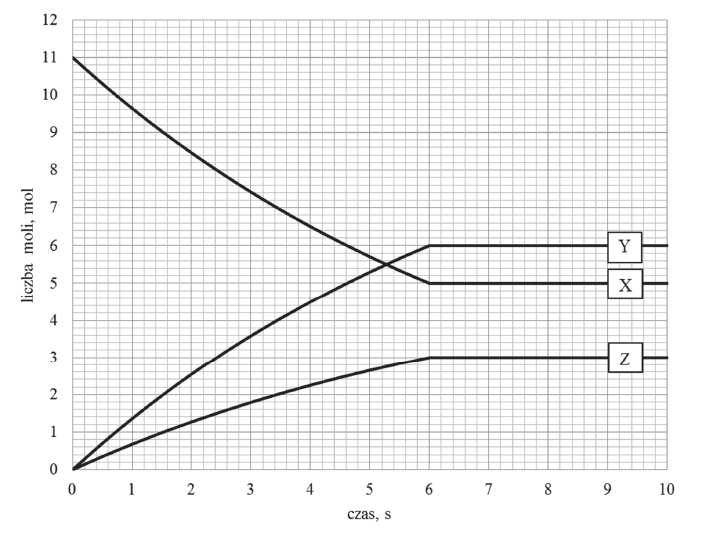
Reakcja, dla której zmianę liczby moli reagentów przedstawiono na wykresie, przebiegała w reaktorze o pojemności 4 dm3. W temperaturze T i pod ciśnieniem p do reaktora wprowadzono substrat reakcji X i badano zmiany liczby moli reagentów w trakcie trwania procesu prowadzącego do ustalenia stanu równowagi dynamicznej.
Oblicz stężeniową stałą równowagi Kc opisanego procesu w temperaturze T.