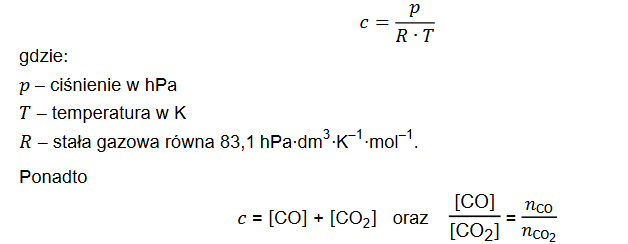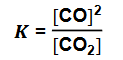obliczenia dotyczące mas substratów i produktów
Arkusz z chemii rozszerzonej czerwiec 2021
Próbkę mieszaniny NaCl i MgCl₂ o masie 3,7 g rozpuszczono w wodzie, a do otrzymanej mieszaniny dodano nadmiar wodnego roztworu AgNO₃. W roztworze zaszła reakcja opisana równaniem:
Ag⁺ + Cl⁻ → AgCl↓
Odsączony, przemyty i wysuszony osad AgCl ważył 10,0 g.
Oblicz masę chlorku magnezu w próbce mieszaniny. Wynik podaj w gramach i zaokrąglij do jednego miejsca po przecinku.
Materiały i tworzywa pochodzenia naturalnego
Arkusz z chemii rozszerzonej marzec 2021
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm³ roztworu, po czym dodano do niego 50,0 cm³ roztworu azotanu(V) baru o stężeniu 0,600 mol·dm⁻³. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe:
M Na₂SO₄ =142 g mol⁻¹
M BaSO₄ = 233 g mol⁻¹
dobieranie współczynników w równaniach reakcji chemicznych
Arkusz z chemii rozszerzonej marzec 2021
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.).
Równanie 1.:
Równanie 2.:
reakcja w zamkniętym reaktorze
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W zamkniętym reaktorze znajdowały się dwa gazy: wodór oraz fluor. Po zakończeniu reakcji zbiornik zawierał tylko fluorowodór, którego masa była równa 0,4 g.
Napisz, w jakim stosunku objętościowym zmieszano wodór z fluorem w reaktorze, oraz określ, ile gramów wodoru i ile gramów fluoru wprowadzono do reaktora.
Stosunek objętości substratów V wodoru : V fluoru = ……
Masa wodoru wprowadzonego do reaktora m wodoru = ……
Masa fluoru wprowadzonego do reaktora m fluoru =……
Produkcja krzemu w piecu elektrycznym
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Produkcja krzemu w skali przemysłowej polega na redukcji tlenku krzemu(IV) węglem w piecu elektrycznym w temperaturze około 2300 K. Reakcja zachodzi zgodnie z równaniem:
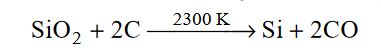
Oblicz, ile kilogramów czystego krzemu można otrzymać z 1 tony piasku kwarcowego zawierającego 85% masowych tlenku krzemu(IV), jeżeli wydajność procesu jest równa 70%. Przyjmij, że pozostałe składniki piasku nie zawierają krzemu.
Uwodniony węglan sodu – bezbarwny kryształ
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Węglan sodu występuje w postaci soli bezwodnej oraz w postaci hydratu zawierającego 63% masowych wody. Obie formy rozpuszczają się w wodzie. Uwodniony węglan sodu tworzy
bezbarwne kryształy, które podczas ogrzewania uwalniają wodę krystalizacyjną i rozpuszczają się w niej.
Rozpuszczalność węglanu sodu (w przeliczeniu na sól bezwodną) w temperaturze 40 °C jest równa 48,8 g na 100 g wody.
1. Wykonaj obliczenia i ustal wzór opisanego hydratu węglanu sodu.
2. Na podstawie obliczeń rozstrzygnij, czy węglan sodu zawarty w opisanym hydracie całkowicie rozpuści się w wodzie krystalizacyjnej w temperaturze 40 °C.
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

interpretacja jakościowej i ilościowej równania reakcji w ujęciu molowym
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
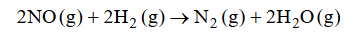
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:2
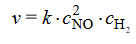
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, CNO CH₂ oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości
k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole wodoru. Podczas reakcji utrzymywano stałą temperaturę.
Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
obliczenia z uwzględnieniem wydajności reakcji i mola
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
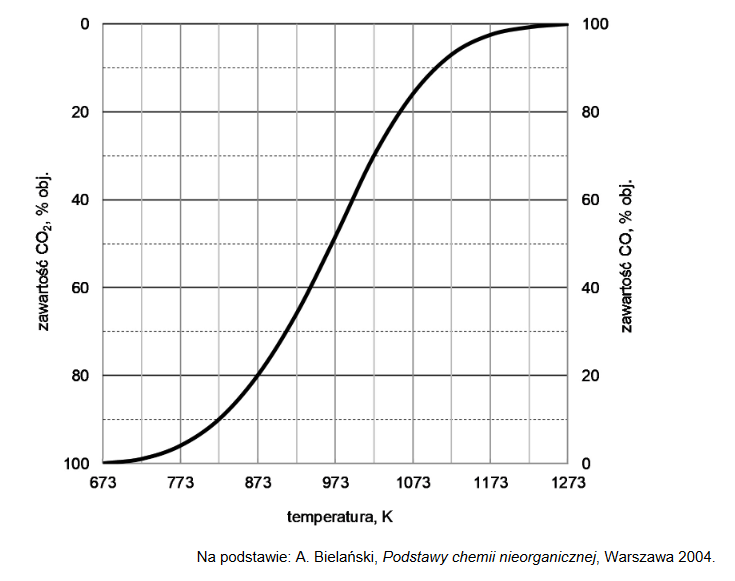
Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
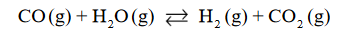
W temperaturze 800 K stężeniowa stała równowagi tej reakcji jest równa 4,0.
W zamkniętym reaktorze o stałej pojemności zmieszano 1 mol tlenku węgla(II) z parą wodną w ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano w temperaturze 800 K aż do osiągnięcia stanu równowagi dynamicznej przez układ
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Stężenie procentowe jodu w jodynie.
Arkusz maturalny z chemii podstawowej maj 2005
Oblicz stężenie procentowe jodu w jodynie, jeżeli otrzymano ją w wyniku rozpuszczenia 8 gramw jodu w 72 gramach etanolu.

Spalanie całkowite węglowodoru. Określanie wzoru sumarycznego i półstrukturalnego.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Podczas spalania 0,25 mola pewnego węglowodoru przebiegła reakcja chemiczna zilustrowana
ogólnym równaniem:
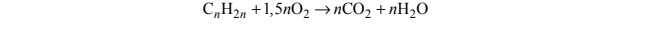
W wyniku opisanej przemiany otrzymano 46,5 g mieszaniny tlenku węgla(IV) i pary wodnej.

Wykonaj obliczenia i zaproponuj wzór półstrukturalny (grupowy) spalanego
węglowodoru.
Kwas etanodiowy o wzorze (COOH)2 jest najprostszym kwasem dikarboksylowym.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Kwas etanodiowy o wzorze (COOH)2 jest najprostszym kwasem dikarboksylowym, którego
rozpuszczalność w wodzie w temperaturze 20 oC jest równa 9,52 g bezwodnego kwasu
w 100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.

Oblicz minimalną masę wody potrzebną do rozpuszczenia 14,0 gramów hydratu kwasu
etanodiowego o wzorze (COOH)2 · 2H2O w temperaturze 20 oC. Wynik końcowy podaj
w gramach i zaokrąglij do jedności.
Oblicz masę mx drugiego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz masę atomową mx drugiego izotopu galu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.