Reakcje redukcji tlenku azotu wodorem.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
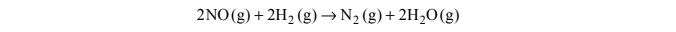
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:
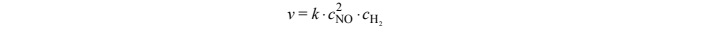
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, c NO i H2 c oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna. Podstawy fenomenologiczne, Warszawa 2007.
W zamkniętym reaktorze o pojemności 2 dm3
zmieszano 6 moli tlenku azotu(II) i 4 mole
wodoru. Podczas reakcji utrzymywano stałą temperaturę.

Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
Reakcja tlenku węgla(II) z parą wodną.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
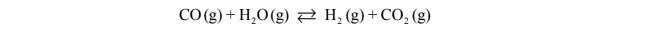
W temperaturze 800 K stężeniowa stała równowagi tej reakcji jest równa 4,0.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
W zamkniętym reaktorze o stałej pojemności zmieszano 1 mol tlenku węgla(II) z parą wodną w ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano
w temperaturze 800 K aż do osiągnięcia stanu równowagi dynamicznej przez układ.

Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.
Reakcję syntezy tlenku azotu(II).
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcję syntezy tlenku azotu(II) ilustruje równanie:
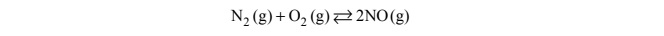
W tabeli podano wartości stężeniowej stałej równowagi Kc reakcji syntezy NO w różnych
temperaturach.
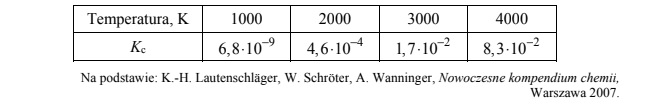
Oceń, czy opisana reakcja jest procesem egzo- czy endotermicznym, oraz spośród poniższych sposobów prowadzenia reakcji wybierz ten powodujący zwiększenie wydajności tworzenia tlenku azotu(II).

Opisana reakcja jest procesem
Numer sposobu zwiększenia wydajności tworzenia tlenku azotu(II):
Stop glinu z magnezem o masie 7.5 g.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Na odważkę stopu glinu z magnezem o masie 7,50 g podziałano nadmiarem rozcieńczonegovkwasu solnego. Podczas roztwarzania stopu w kwasie solnym zachodziły reakcje zilustrowanebrównaniami:

W wyniku całkowitego roztworzenia stopu otrzymano klarowny roztwór, do którego dodano nadmiar wodnego roztworu wodorotlenku sodu. Zaszły reakcje opisane równaniami:
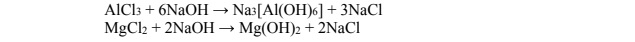
Otrzymany nierozpuszczalny w wodzie związek odsączono, przemyto wodą, wysuszono
i zważono. Jego masa (w przeliczeniu na czysty wodorotlenek magnezu) była równa 11,67 g.
Oblicz zawartość procentową glinu w stopie (w procentach masowych).

Klarowny roztwór uzyskany po odsączeniu osadu Mg(OH)2 nasycono tlenkiem węgla(IV).
Zaobserwowano wytrącenie białego osadu wodorotlenku glinu.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej.
Zmiany pH roztworów po dodaniu różnych związków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Przeprowadzono doświadczenie, w którym do czterech ponumerowanych zlewek I–IV
zawierających po 100 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 3 0,1 mol dm− ⋅ dodano wodne roztwory różnych substancji i wodę destylowaną zgodnie z poniższym rysunkiem.
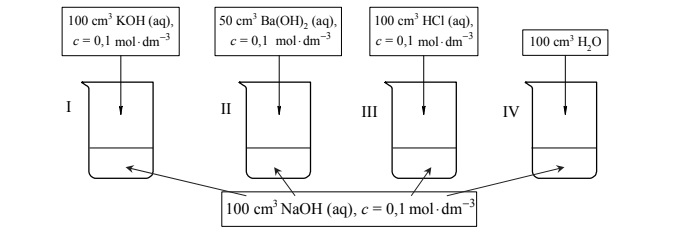

Uzupełnij poniższą tabelę – podaj wartość pH wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol · dm–3 oraz wpisz numery zlewek, w których pH otrzymanego roztworu było niższe albo było wyższe od pH roztworu wyjściowego, albo nie uległo zmianie w czasie doświadczenia.
Rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu. Hydrat. Sól uwodniona.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W temperaturze 20 °C rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze
NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 °C stanowi masa soli
bezwodnej NaHSO4.

Obliczanie pH roztworu. Reakcja zobojętniania.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Do 10 cm3
kwasu solnego o pH = 1 dodano 20 cm3
wodnego roztworu wodorotlenku sodu
o stężeniu 0,2 3 mol dm− ⋅ . Przebiegła wtedy reakcja opisana równaniem
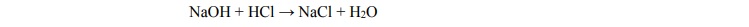
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego
roztworu jest sumą objętości roztworów wyjściowych.

Przeliczanie karatów złota.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Złoto jest doskonale kowalnym żółtym metalem o silnym połysku. W czystej postaci jest
stosunkowo miękkie, więc w wyrobach jubilerskich stosuje się stopy złota z innymi metalami,
np. srebrem lub miedzią. Zawartość czystego złota w tych wyrobach podaje się w jednostkach
zwanych karatami. Jeden karat odpowiada 1/24 zawartości masowej złota w stopie, co oznacza,
że czyste złoto jest 24-karatowe. Złoto jest metalem szlachetnym, więc trudno ulega reakcjom
chemicznym. Roztwarza się w wodzie królewskiej, przy czym powstaje m.in. chlorkowy
kompleks złota(III), co ilustruje poniższe równanie:

Oblicz, ile gramów czystego złota należy stopić z 10 gramami 15-karatowego złota, aby
otrzymać złoto 18-karatowe.

Substratem do otrzymywania pirytu jest kwas siarkowy (VI)
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
W jednej z przemysłowych metod otrzymywania kwasu siarkowego(VI) jako substrat
pierwszego etapu stosuje się piryt (FeS2) – powszechnie występujący minerał.

W wyniku opisanego procesu – do którego na pierwszym etapie wykorzystano
100 gramów pirytu niezawierającego zanieczyszczeń – otrzymano wodny roztwór kwasu
siarkowego (VI) o stężeniu 96% masowych. Sumaryczna wydajność procesu była równa 85%.
Oblicz masę wodnego roztworu kwasu siarkowego(VI) uzyskanego w opisanym procesie.

Reakcje spalania węglowodorów. Reakcje całkowitego spalaniametanu oraz dowolnego alkanu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Do całkowitego spalenia 2,80 dm3
(odmierzonych w warunkach normalnych) mieszaniny
zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu
potrzeba 13,16 dm3
tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania
metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
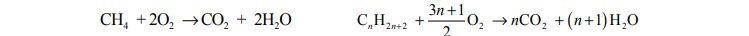
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu, stanowiącego 60%
objętości opisanej mieszaniny.

Rozkład termiczny węglanu wapnia.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W wysokiej temperaturze (900–1000 °C) węglan wapnia ulega rozkładowi, którego przebieg opisuje równanie:
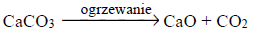
Próbkę węglanu wapnia o masie 10,00 gramów prażono przez pewien czas w otwartym naczyniu. Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowało się 6,04 grama substancji stałych.
Oblicz, jaki procent początkowej masy węglanu wapnia nie uległ rozkładowi.
Asocjacja cząsteczek fluorowodoru.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Cząsteczki fluorowodoru ulegają asocjacji, czyli łączą się ze sobą, tworząc zygzakowate łańcuchy. W temperaturze bliskiej temperatury wrzenia równej 293,7 K i pod ciśnieniem p = 1013 hPa gęstość par fluorowodoru wynosi
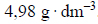
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
1. Oblicz masę molową asocjatu fluorowodoru (HF)n w temperaturze 293,7 K i pod ciśnieniem 1013 hPa oraz ustal liczbę cząsteczek n tworzących ten asocjat. Objętość molowa gazu w tych warunkach temperatury i ciśnienia jest równa
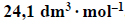
2. Wyjaśnij, dlaczego cząsteczki fluorowodoru ulegają asocjacji.
Prażenie węglanu wapnia.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W wysokiej temperaturze (900–1000 °C) węglan wapnia ulega rozkładowi, którego przebieg opisuje równanie:
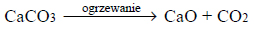
Próbkę węglanu wapnia o masie 10,00 gramów prażono przez pewien czas w otwartym naczyniu. Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowało się 6,04 grama substancji stałych.
Oblicz, jaki procent początkowej masy węglanu wapnia nie uległ rozkładowi.
Objętość amoniaku w mieszaninie poreakcyjnej.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
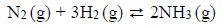
W mieszaninie wodoru i azotu użytej do syntezy amoniaku zawartość wodoru wyrażona w procentach objętościowych jest równa 75%. Wydajność reakcji syntezy amoniaku przeprowadzonej w temperaturze T i pod ciśnieniem p jest równa 93%.
Oblicz wyrażoną w procentach objętościowych zawartość amoniaku w mieszaninie poreakcyjnej.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Próbkę czystego węglanu wapnia o masie m prażono przez pewien czas w otwartym naczyniu. Przebiegła wtedy reakcja zilustrowana równaniem:
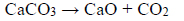
Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowała się mieszanina substancji stałych o masie 18,0 gramów. Ustalono, że w tej mieszaninie zawartość węglanu wapnia wyrażona w procentach masowych jest równa 57,5%.
Oblicz masę m próbki węglanu wapnia, którą poddano prażeniu.