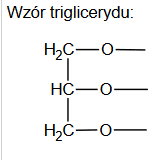
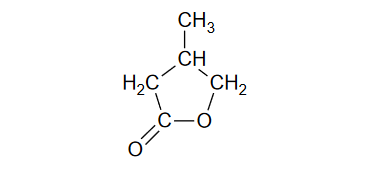
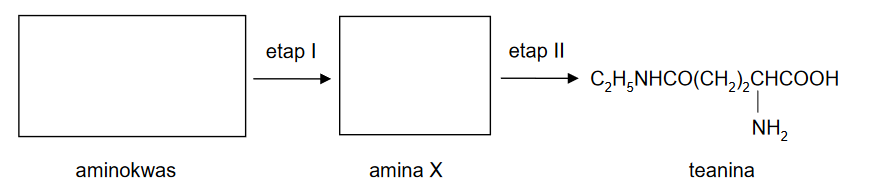
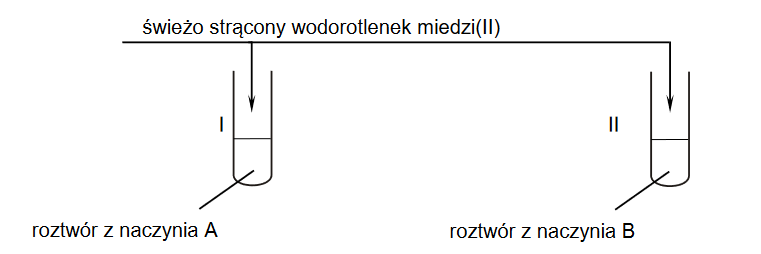
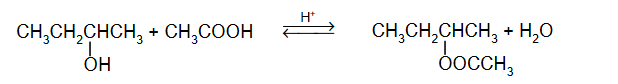
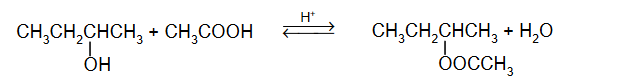
właściwości chemiczne kwasów karboksylowych
Arkusz diagnostyczny z chemii 2022 grudzień
Uczniowie badali zachowanie związków organicznych wobec kwasów i zasad. Mieli do dyspozycji: propano–1–aminę, propan–1–ol, glicynę oraz kwas propanowy. Te związki zostały w przypadkowej kolejności oznaczone numerami 1–4.
W pierwszym etapie doświadczenia badane związki wprowadzono pojedynczo do czterech probówek zawierających kwas solny z dodatkiem oranżu metylowego, a w drugim etapie – do czterech probówek zawierających roztwór NaOH z dodatkiem fenoloftaleiny. Efekty doświadczenia pokazano na zdjęciach.

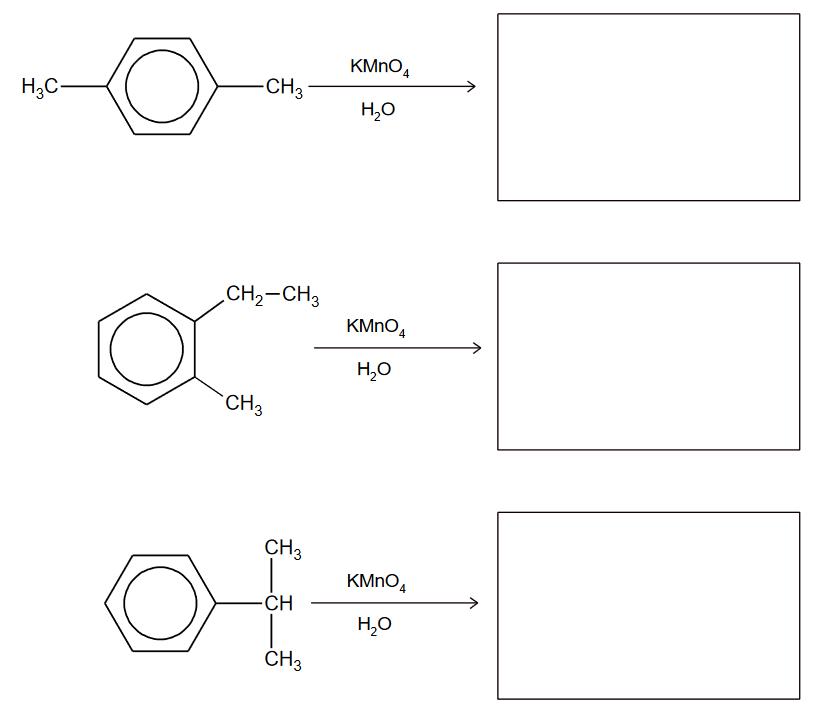
Benzen – całkowitaodporność na działanie wodnego roztworu KMnO4
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Benzen wykazuje całkowitą odporność na działanie wodnego roztworu KMnO4, ale grupy alkilowe przy pierścieniu benzenowym są podatne na utlenianie. Każda grupa alkilowa ulega utlenieniu aż do momentu, gdy powstanie z niej grupa karboksylowa związana bezpośrednio z pierścieniem aromatycznym.
Uzupełnij poniższe schematy. Napisz wzory półstrukturalne (grupowe) lub uproszczone kwasów karboksylowych powstających w wyniku całkowitego utlenienia poniższych związków roztworem KMnO4.
Reakcja aldolowa i jej produkt β-hydroksyaldehyd
Arkusz z chemii rozszerzonej marzec 2021
Reakcja aldolowa, przebiegająca w środowisku rozcieńczonej zasady, prowadzi do połączenia dwóch cząsteczek aldehydu lub ketonu i utworzenia wiązania między atomem węgla α jednej
cząsteczki i karbonylowym atomem węgla drugiej cząsteczki. Produktem jest β-hydroksyaldehyd (aldol) lub β-hydroksyketon. Reakcji ulegają wszystkie aldehydy i ketony zawierające atomy wodoru α, czyli atom wodoru zlokalizowany przy atomie węgla połączonym z grupą aldehydową lub ketonową. Jeśli etanal zostanie poddany działaniu zasady, takiej jak etanolan sodu lub wodorotlenek sodu, wówczas zachodzi szybka, odwracalna reakcja:
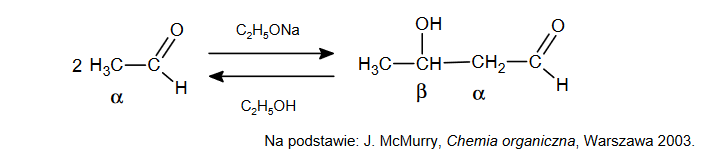
1. Napisz nazwę systematyczną produktu reakcji aldolowej etanalu.
2. Napisz równanie reakcji aldolowej propanalu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
właściwości redukujące kwasu metanowego
Arkusz z chemii rozszerzonej marzec 2021
Celem doświadczenia przedstawionego na poniższym schemacie było potwierdzenie właściwości redukujących kwasu metanowego.
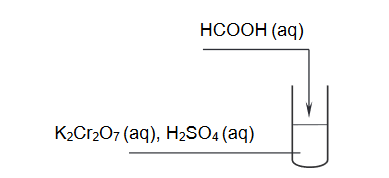
1. Spośród poniższych obserwacji wybierz i podkreśl wszystkie te zmiany, które można zaobserwować podczas wykonanego doświadczenia.
• wytrąca się zielony osad
• roztwór zmienia barwę z pomarańczowej na ciemnozieloną
• fioletowy roztwór się odbarwia
• roztwór zmienia barwę z pomarańczowej na żółtą
• wydziela się gaz
2. Wyjaśnij na podstawie budowy cząsteczki, dlaczego kwas metanowy wykazuje właściwości redukujące.
Rozpoznawanie związku po jego wzorze
Arkusz z chemii rozszerzonej marzec 2021
Poniżej przedstawiono wzór związku zawierającego azot.
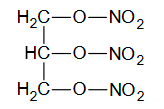
Zaznacz poprawne dokończenie zdania.
Związek o podanym wzorze jest
A. solą kwasu azotowego(III).
B. solą kwasu azotowego(V).
C. estrem kwasu azotowego(V).
D. związkiem nitrowym.
porównania mocy substancji chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W celu porównania mocy kwasu siarkowego(VI), fenolu, kwasu etanowego i kwasu węglowego przeprowadzono doświadczenie zilustrowane poniższym schematem. Wszystkie użyte roztwory zostały świeżo przygotowane.
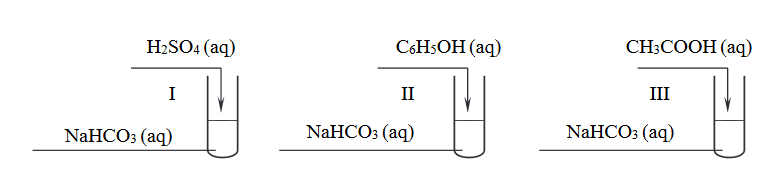
W probówkach I i III zaobserwowano wydzielanie się pęcherzyków gazu, a w probówce II – po zmieszaniu wodnych roztworów użytych do doświadczenia – nie przebiegła reakcja wodorowęglanu sodu z fenolem.
1. Sformułowane obserwacje i wnioski nie pozwalają na jednoznaczne określenie mocy badanych kwasów.
Jaką reakcję chemiczną należy dodatkowo przeprowadzić, aby możliwe było uszeregowanie wszystkich badanych kwasów od najsłabszego do najmocniejszego? Uzupełnij schemat – wybierz i podkreśl wzór jednego odczynnika z zestawu I oraz wzór jednego odczynnika z zestawu II.
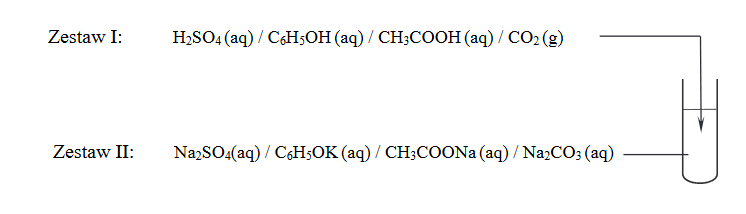
2. Napisz w formie cząsteczkowej równanie reakcji zachodzącej podczas dodatkowego doświadczenia.
identyfikacja pewnego estru
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Ester E o masie molowej 178 g ∙ mol −1 zawiera 74,16% masowych węgla. Ten związek otrzymano w reakcji nasyconego monohydroksylowego alkoholu A wykazującego czynność
optyczną oraz monokarboksylowego aromatycznego kwasu B. Sól sodowa kwasu B jest stosowana jako konserwant.
1. Wykonaj odpowiednie obliczenia i ustal wzór półstrukturalny (grupowy) opisanego estru.
2. Napisz w formie jonowej skróconej równanie hydrolizy estru E przebiegającej w środowisku zasadowym.