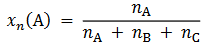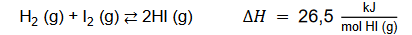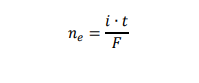Obserwacja zmian energii wewnętrznej układu w wyniku przemiany chemicznej
INFORMATOR o egzaminie maturalnym z chemii 22/23
Przeprowadzono doświadczenie, którego celem była obserwacja zmian energii wewnętrznej badanego układu w wyniku przemiany chemicznej. W procesie przeprowadzonym w warunkach izotermiczno-izobarycznych wprowadzono do cylindra gazowy tlen oraz sproszkowane żelazo i zamknięto ten cylinder ruchomym tłokiem. Schemat doświadczenia przedstawiono na poniższym rysunku.
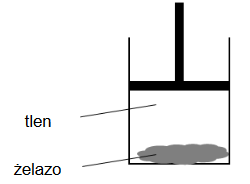
W warunkach doświadczenia reakcja zachodziła z niewielką szybkością. Ścianki cylindra umożliwiały wymianę ciepła z otoczeniem.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W wyniku przebiegu opisanego procesu tlen się zużywa, a tłok przesuwa się (w dół / w górę), wykonując pracę nad układem. Przemianie żelaza w tlenek żelaza(III) towarzyszyło odprowadzenie ciepła do otoczenia, co oznacza, że ta reakcja jest procesem (endoenergetycznym / egzoenergetycznym).
Reakcja rozkładu azotanu(V) ołowiu(II)
Informator o egzaminie maturalnym z biologii - 2022/23
Reakcja rozkładu azotanu(V) ołowiu(II) jest procesem endoenergetycznym i przebiega zgodnie z równaniem:
2Pb(NO 3) 2 → 2PbO + 4NO 2↑ + O 2↑
Wartości standardowych entalpii tworzenia związków biorących udział w opisanej reakcji podano w poniższej tabeli.

Oblicz, ile energii na sposób ciepła należy dostarczyć, aby całkowicie rozłożyć 3,31 g Pb(NO 3)2.
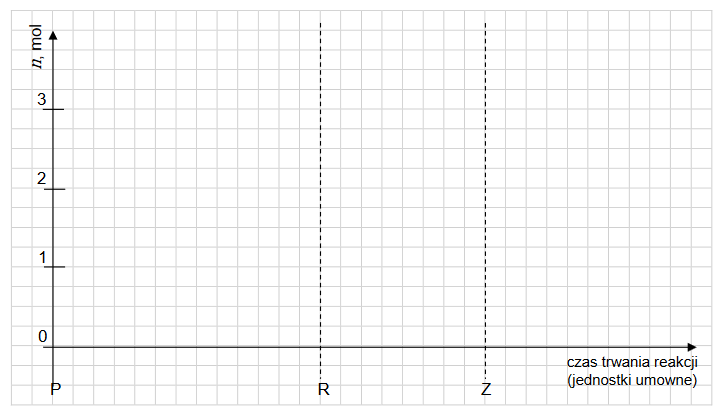
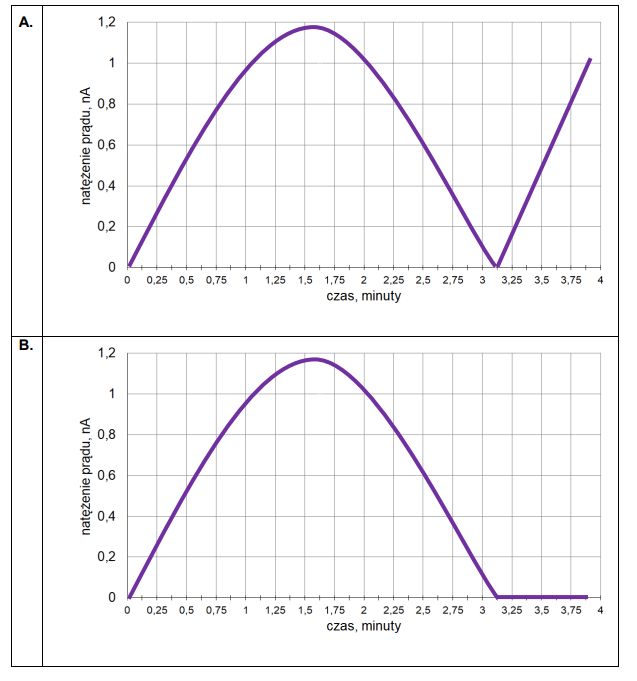
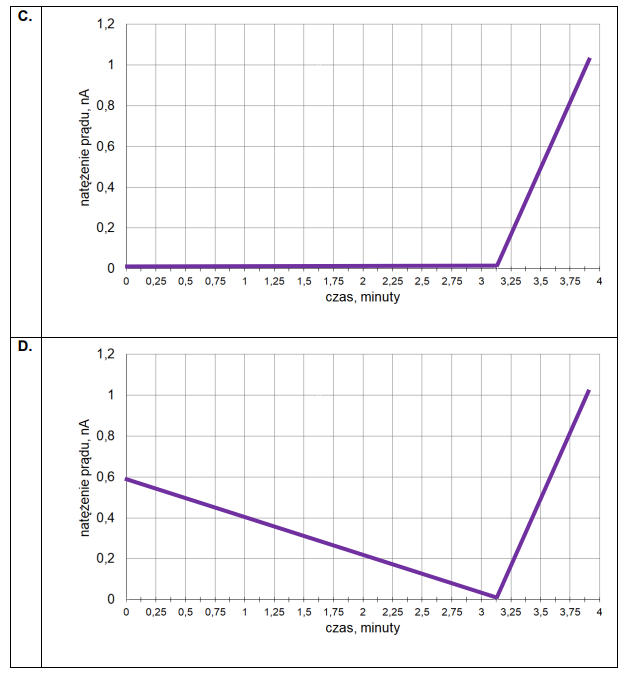
Wykres zmian stężeń reagentów w czasie
INFORMATOR o egzaminie maturalnym z chemii 22/23
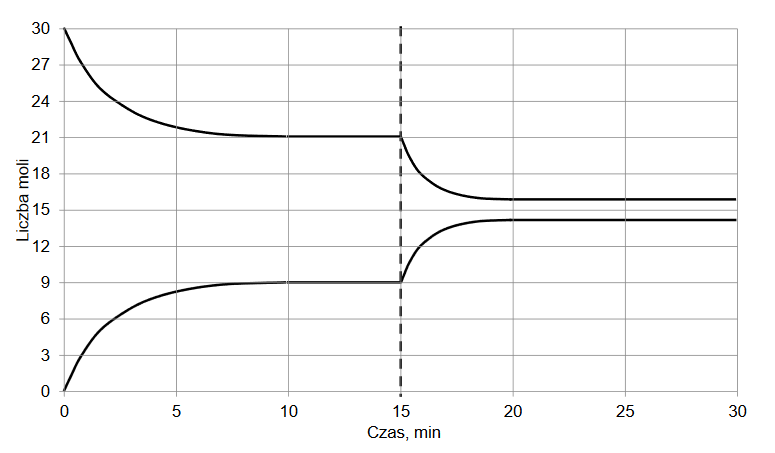
Do reaktora o stałej pojemności, z którego usunięto powietrze, wprowadzono próbkę gazowego związku A i zainicjowano reakcję. W zamkniętym reaktorze ustaliła się równowaga opisana równaniem:
A (g) ⇄ 2B (g)
Mierzono stężenie związku A w czasie trwania reakcji. Tę zależność przedstawiono na poniższym wykresie:
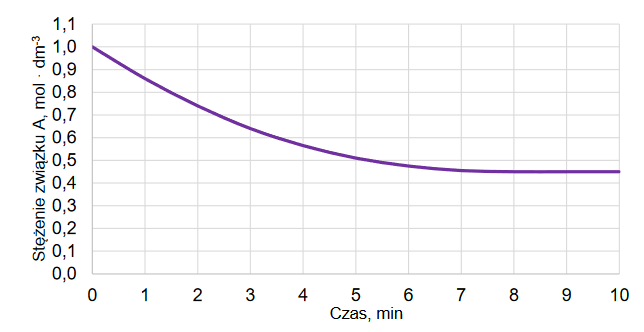
Z poniższych wykresów wybierz ten, który jest ilustracją zależność stężenia związku B od czasu trwania reakcji. Zaznacz wykres A, B, C albo D i uzasadnij swój wybór.
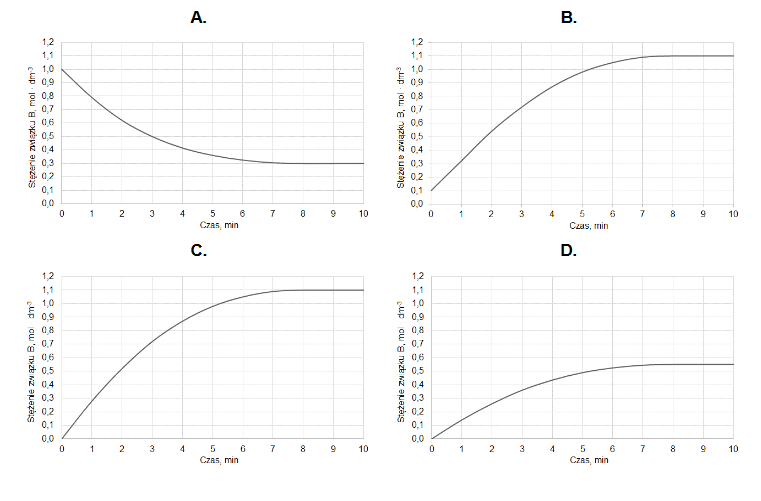
Uzasadnienie:
Półogniwo – rola katody i anody
INFORMATOR o egzaminie maturalnym z chemii 22/23
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

Półogniwa – przewidywanie produktów elektrolizy
INFORMATOR o egzaminie maturalnym z chemii 22/23
W półogniwach A i B zachodzą reakcje opisane równaniami:

Zbudowano ogniwo z półogniw A i B.
1. Oblicz siłę elektromotoryczną (SEM) ogniwa zbudowanego z półogniwa A i półogniwa B w warunkach standardowych.
2. Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w ogniwie zbudowanym z półogniw A i B.
3. Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w nawiasie.
W procesie elektrolizy, podczas przepływu prądu przez wodny roztwór siarczanu(VI) miedzi(II) elektrony (są pobierane z katody / są przekazywane na katodę) przez kationy Cu2+. Obecne w roztworze jony miedzi(II) ulegają procesowi (redukcji / utleniania), a efektem tego jest (zwiększenie / zmniejszenie) masy katody.
elektroliza stopionego tlenku glinu
INFORMATOR o egzaminie maturalnym z chemii 22/23
W czasie elektrolizy stopionego tlenku glinu prowadzonej w temperaturze 2050°C i pod ciśnieniem 1013 hPa zachodzą procesy elektrodowe zilustrowane równaniami:
Al3+ + 3e− → Al
2O2− → O2 + 4e−
Podczas tego procesu wydzielił się tlen. Objętość tlenu zmierzona w warunkach prowadzenia elektrolizy była równa 43,85 dm3.
Oblicz, ile gramów glinu otrzymano w czasie elektrolizy stopionego tlenku glinu. Przyjmij, że oba procesy elektrodowe przebiegły z wydajnością równą 100%.
Uniwersalna stała gazowa R = 83,1 dm3 · hPa · mol–1 ⋅ K–1.
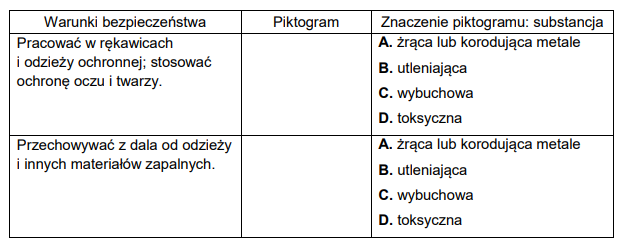
piktogramy – oznaczanie niebezpiecznych substancji i mieszanin
INFORMATOR o egzaminie maturalnym z chemii 22/23
Poniżej przedstawiono wybrane piktogramy stosowane do oznaczania niebezpiecznych substancji i mieszanin.
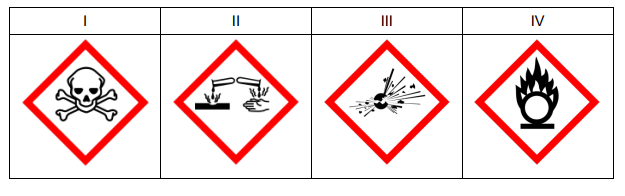
Spośród przedstawionych piktogramów wybierz dwa stosowane do opisu zagrożeń wynikających ze stosowania w laboratorium kwasu azotowego(V). Uzupełnij tabelę –
wpisz oznaczenia cyfrowe wybranych piktogramów i zaznacz literę wskazującą znaczenie danego piktogramu.