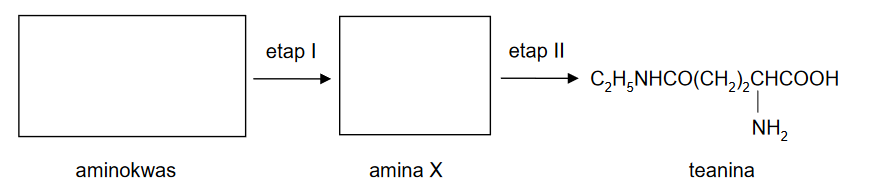
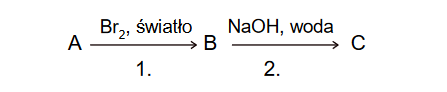Nadtlenek sodu i jego reakcje
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Produktem spalania metalicznego sodu w tlenie jest nadtlenek sodu o wzorze Na2O2. W wyniku reakcji tego związku z sodem w podwyższonej temperaturze można otrzymać tlenek sodu Na2O. Każdy z opisanych związków sodu z tlenem ma budowę jonową i tworzy sieć krystaliczną zbudowaną z kationów i anionów.
Nadtlenek sodu reaguje gwałtownie z wodą. Jednym z produktów tej reakcji, zachodzącej bez zmiany stopni utlenienia, jest nadtlenek wodoru H2O2.
1. Napisz wzór anionu występującego w nadtlenku sodu oraz wzór anionu występującego w tlenku sodu.
Wzór anionu w nadtlenku sodu:
Wzór anionu w tlenku sodu:
2. Napisz w formie cząsteczkowej równanie reakcji nadtlenku sodu z wodą.
obliczenia związane z rozcieńczaniem roztworów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do 1,00 dm3 wody destylowanej wprowadzono 90,0 cm3 wodnego roztworu kwasu azotowego(V) o stężeniu 5,00 % masowych i gęstości równej 1,03 g * cm–3.
Oblicz pH otrzymanego roztworu kwasu azotowego(V). W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworu i wody. Wynik zaokrąglij do drugiego miejsca po przecinku.
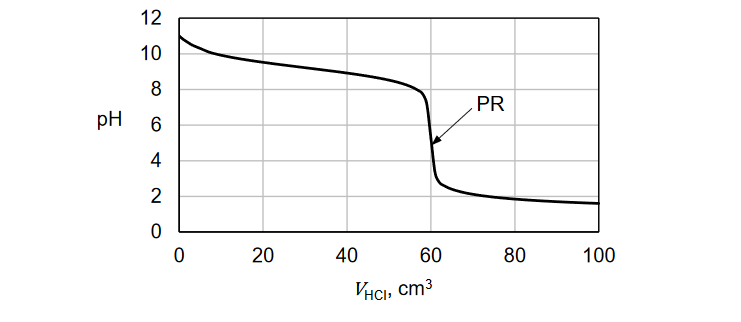
przewidywanie odczynu roztworu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Zmieszano wodny roztwór kwasu azotowego(V) z wodnym roztworem wodorotlenku potasu w stosunku objętościowym vHNO3 : vKOH = 2 : 1. Otrzymano klarowny roztwór o pH = 7.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

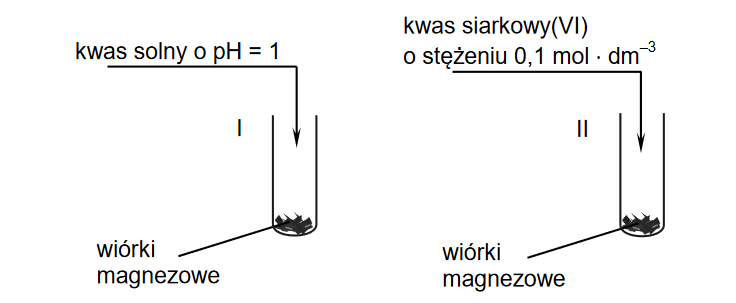
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
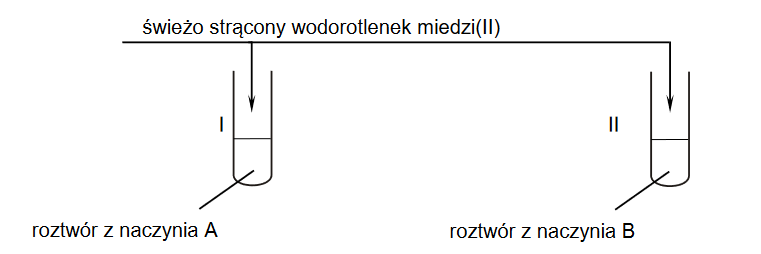
Przygotowano wodne roztwory trzech różnych soli – CH3COONa, NaNO2, NaF – o takim samym stężeniu molowym. Odczyn wszystkich przygotowanych roztworów był zasadowy, ale pH każdego roztworu było inne.
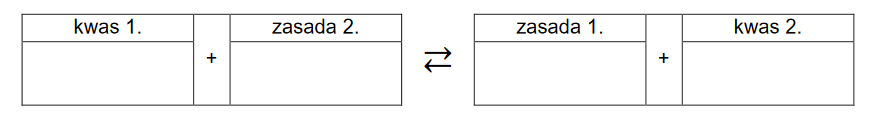
1. Wpisz do poniższego schematu wzory odpowiednich drobin, tak aby powstało równanie potwierdzające zasadowy odczyn roztworu azotanu(III) sodu – zastosuj definicję kwasu i zasady Brønsteda.
2. Napisz wzór lub nazwę tej soli, której wodny roztwór miał najwyższe pH.
Równanie kinetyczne reakcji – obliczenia
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Równanie kinetyczne reakcji opisanej równaniem:
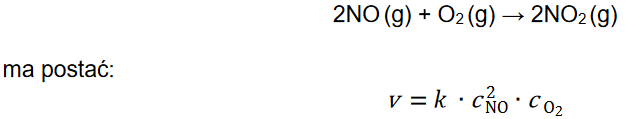
Szybkość reakcji chemicznej v, wyrażona w jednostce: mol *dm−3 * s−1, zależy od stężeń molowych substratów reakcji oraz od stałej szybkości reakcji 𝑘 – współczynnika charakterystycznego dla danej reakcji. Stała szybkości reakcji zależy od temperatury, a nie zależy od stężenia substratów.
1. Napisz jednostkę stałej szybkości reakcji 𝒌 w równaniu kinetycznym opisanej reakcji.
2. W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole tlenu. Podczas reakcji utrzymywano stałą temperaturę T.
Oblicz, ile razy zmaleje szybkość opisanej reakcji w stosunku do szybkości
początkowej, w momencie, w którym stężenie tlenu zmniejszy się o 1 mol * dm−3.
standardowe półogniwo
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
W standardowym półogniwie A ustala się równowaga opisana równaniem:
MnO4− + 8H+ + 5e− ⇄ Mn2+ + 4H2O
Po połączeniu tego półogniwa ze standardowym półogniwem B otrzymano ogniwo, którego siła elektromotoryczna (SEM) jest równa 0,971 V.
Napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
elektroda bromosrebrowa – przykład elektrody halogenosrebrowej
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Przykładem elektrody halogenosrebrowej jest elektroda bromosrebrowa, której działanie opisano równaniem:
AgBr (s) + e– ⇄ Ag (s) + Br– (aq)
Potencjał tej elektrody zależy od stężenia jonów bromkowych i w temperaturze 298 K wyraża się równaniem:
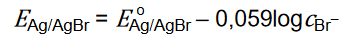
Standardowy potencjał tej elektrody EAg/AgBr = 0,071 V.
W temperaturze 298 K potencjał elektrody bromosrebrowej zanurzonej w wodnym roztworze bromku srebra pozostającym w równowadze z osadem tej soli był równy EAg/AgBr = 0,431 V.
Oblicz wartość iloczynu rozpuszczalności bromku srebra 𝑲𝒔[AgBr] w temperaturze 298 K.
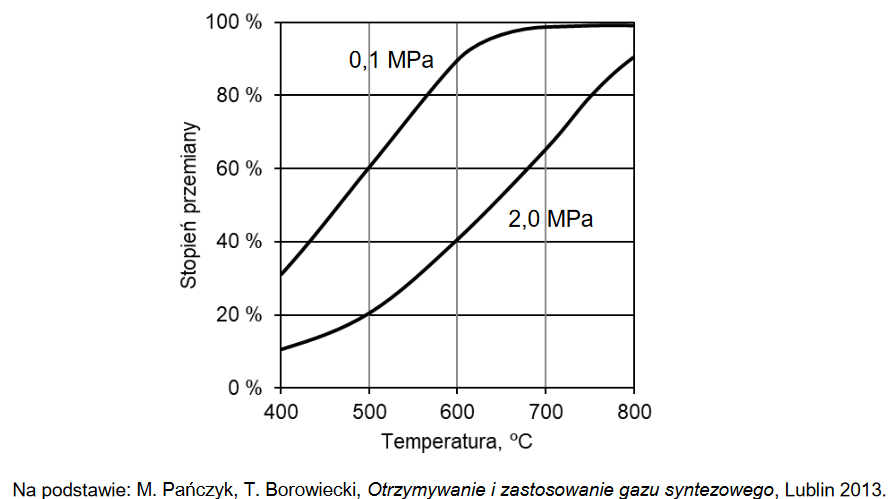
wpływ zmian temperatury i zmian ciśnienia w układzie na wydajność otrzymywania produktu
INFORMATOR o egzaminie maturalnym z chemii 22/23
Zbadano wpływ zmian temperatury (doświadczenie I) i zmian ciśnienia (doświadczenie II) w układzie na wydajność otrzymywania produktu X w reakcji opisanej schematem:
aA (g) + bB (g) ⇄ xX (g)
Wyniki pomiarów zamieszczono w poniższych tabelach. Zawartość produktu X w mieszaninie równowagowej wyrażono w procentach objętościowych.
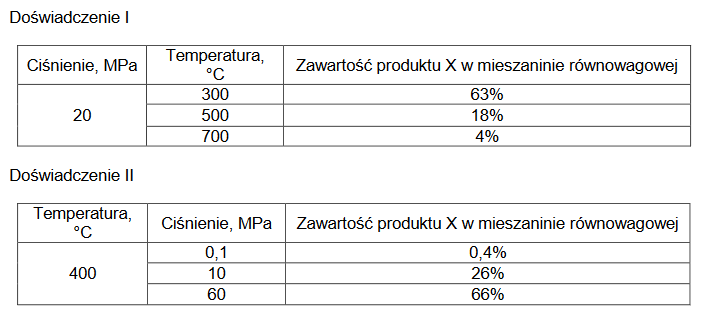
Na podstawie przedstawionych wyników pomiarów wybierz spośród wymienionych poniżej proces, który zachodził w badanym układzie. Napisz numer wybranego procesu. Odpowiedź uzasadnij.

Numer procesu:
Uzasadnienie: