Jeżeli w reakcji redoks biorą udział jony H+, to potencjał układu zależy od stężenia tych jonów, czyli od pH roztworu. Dla takich układów potencjał odnosi się do roztworów, w których
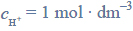
a więc pH = 0. Wartości potencjałów redoks wielu ważnych biologicznie układów utleniacz – reduktor przedstawiane są dla przyjętego przez biochemików stanu, w którym pH = 7, p = 1013 hPa, T = 298 K. Różnica pH roztworu wpływa na wartość potencjału półogniwa.
Potencjał półogniwa wodorowego
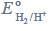
w środowisku o pH różnym od zera można obliczyć (w woltach), korzystając z następującej zależności:
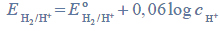
gdzie
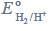
oznacza potencjał standardowy półogniwa wodorowego.
Na podstawie: Lubert Stryer, Biochemia, Warszawa 2003 oraz K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
a) Oblicz potencjał półogniwa wodorowego w stanie, w którym pH = 7, p = 1013 hPa, T = 298 K.
Poniżej przedstawiono równania reakcji i potencjały redoks dwóch układów biologicznych dla pH = 7, p = 1013 hPa, T = 298 K.
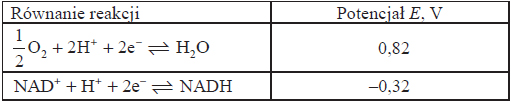
b) Oceń, czy reakcja zilustrowana równaniem
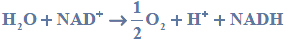
zachodzi samorzutnie, czy do jej zajścia konieczne jest dostarczenie energii. Uzupełnij poniższe zdanie: wybierz i podkreśl jedno określenie w każdym nawiasie.
Aby mogła zajść opisana reakcja, (jest / nie jest) konieczne dostarczenie energii, ponieważ woda jest reduktorem (silniejszym / słabszym) niż NADH.