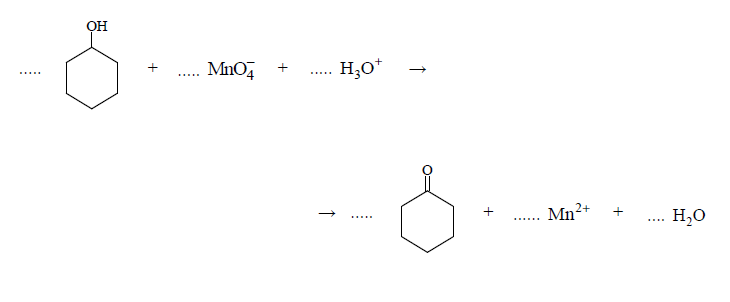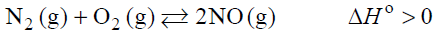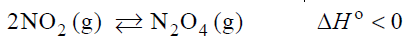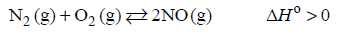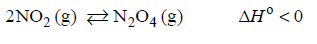Reduktory i utleniacze.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Ze zbioru:
Fe
Ni
Co
Hg
Mn2+
Cd2+
Cu2+
Ag+
wybierz drobiny, które spełniają warunki opisane w poniższej tabeli. Symbole i wzory wybranych drobin wpisz w wyznaczone miejsca.

Wpływ na szybkość reakcji oraz na stałą równowagi.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Tlenek azotu(II) można otrzymać w łuku elektrycznym w wyniku endotermicznej reakcji odwracalnej zilustrowanej poniższym równaniem.
N2 (g) + O2 (g) ⇄ 2NO (g)
Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej.
zmaleje
wzrośnie
nie ulegnie zmianie
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost temperatury, to wartość stałej równowagi opisanej reakcji ………………………………………… .
Jeśli w układzie będącym w stanie równowagi nastąpi wzrost ciśnienia (T=const), to wydajność opisanej reakcji ………………………………………… .
Jeśli do układu będącego w stanie równowagi wprowadzi się katalizator, to ilość NO w układzie ………………………………………… .
Jeśli z układu będącego w stanie równowagi usunie się część azotu, to ilość tlenu w układzie ………………………………………… .

Standardowa entalpia metanalu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
W tabeli podano wartości standardowej entalpii spalania metanu, wodoru i węgla.

Oblicz standardową entalpię tworzenia metanu. Oceń, czy poprawne jest twierdzenie, że w reakcji syntezy metanu z pierwiastków produkt ma energię wyższą od substratów. Uzasadnij swoją ocenę.
Redukcja jodanów za pomocą wodorosiarczanu (IV) sodu
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa 1994
Jedną z opisanych reakcji przedstawia poniższy schemat.
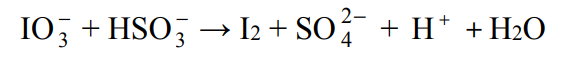
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie procesu redukcji:
Równanie procesu utleniania:
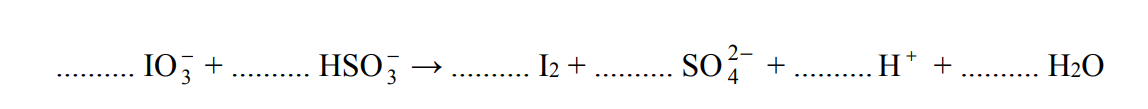
Ustalanie stałej równowagi dla reakcji tlenku węgla(II) z wodą
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Stężeniowa stała równowagi reakcji
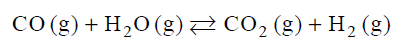
w temperaturze 1000 K jest równa 1.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W reaktorze o stałej pojemności znajdowało się 6 moli tlenku węgla(II).
Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora, aby po ustaleniu się równowagi w temperaturze 1000 K liczba moli wodoru była dwa razy większa od liczby moli tlenku węgla(II).
Który z kationów jest najsilniejszym utleniaczem?
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
W poniższej tabeli podana jest informacja dotycząca barwy wodnych roztworów zawierających wybrane jony.
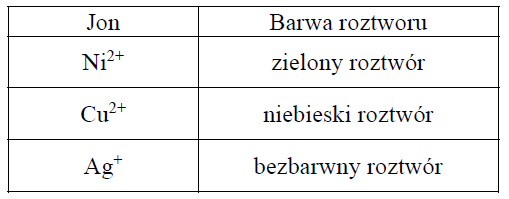
Płytki wykonane z dwóch metali: miedzi i niklu, zanurzono do roztworów azotanu(V) srebra(I) znajdujących się w dwóch oddzielnych probówkach. Przebieg doświadczenia zilustrowano na poniższym schemacie.
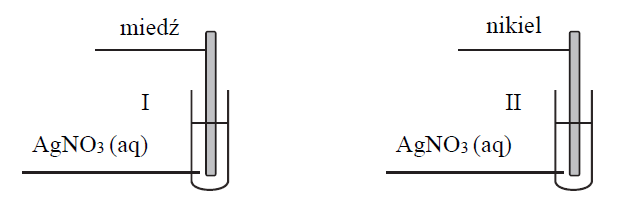
Po pewnym czasie trwania doświadczenia w każdej probówce zaobserwowano zmianę barwy roztworu.
Spośród kationów: Ag+, Cu2+, Ni2+, wybierz i napisz wzór tego kationu, który jest najsilniejszym utleniaczem.
Stała stężeniowa reakcji wody z tlenkiem węgla(IV)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Stężeniowa stała równowagi reakcji
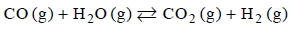
w temperaturze 1000 K jest równa 1.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W reaktorze o stałej pojemności znajdowało się 6 moli tlenku węgla(II).
Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora, aby po ustaleniu się równowagi w temperaturze 1000 K liczba moli wodoru była dwa razy większa od liczby moli tlenku węgla(II).
Ogniwo galwaiczne ołowiano magnezowe.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W ogniwie galwanicznym zachodzi reakcja opisana równaniem:
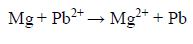
Uzupełnij poniższy schemat ogniwa, w którym zachodzi opisana reakcja. Wpisz symbole metali i wzory jonów oraz zaznacz w tym ogniwie ładunki elektrod (+ albo –).
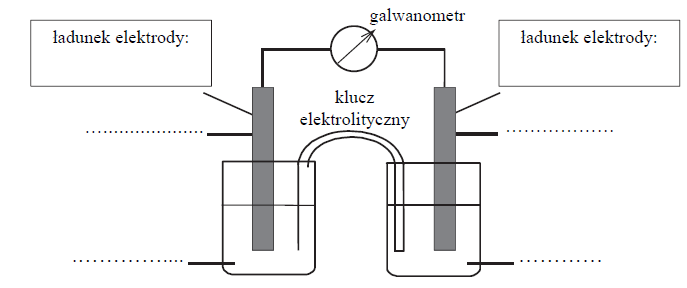
Oblicz SEM tego ogniwa w warunkach standardowych.
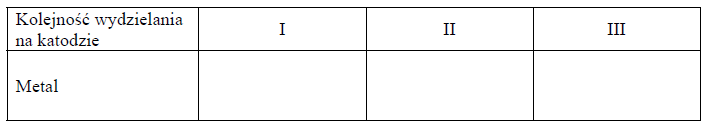
Sole miedzi(II), niklu(II) oraz srebra(I)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W 1 dm3 wody rozpuszczono sole miedzi(II), niklu(II) oraz srebra(I), zawierające identyczny anion. W otrzymanym roztworze stężenie molowe kationów wszystkich metali było jednakowe. Przez ten roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech metali.
Uzupełnij poniższą tabelę – wpisz nazwy lub symbole metali w kolejności ich wydzielania na katodzie.
Wybierz i podkreśl nazwy wszystkich anionów, które mogłyby wchodzić w skład soli użytych w doświadczeniu, jeżeli proces prowadzono na elektrodach grafitowych, a na anodzie wydzielił się tylko bezbarwny i bezwonny gaz. Napisz równanie reakcji zachodzącej na anodzie.
Aniony:
azotany(V)
chlorki
siarczany(VI)
Równanie reakcji:
Elektroliza soli zawierającej kationy metalu X3+
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Podczas przepływu prądu o natężeniu 2 A przez wodny roztwór soli zawierającej jony metalu X3+ wydzieliło się 2,08 g tego metalu w ciągu 1,5 h. Stała Faradaya F = 96500 C · mol–1.
Oblicz masę molową metalu X. Przyjmij, że podczas elektrolizy nie zachodziły na katodzie inne procesy redukcji.
Redukcja manganianu poprzez cykloheksanol
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Cykloheksanol reaguje z manganianem(VII) potasu w środowisku kwasowym zgodnie z poniższym schematem.
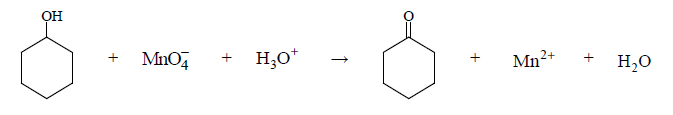
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania reakcji redukcji i utleniania zachodzących w czasie opisanej przemiany. Uwzględnij, że reakcja przebiega w środowisku kwasowym. Dobierz współczynniki stechiometryczne w poniższym schemacie.
Równanie reakcji redukcji:
Równanie reakcji utleniania: