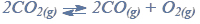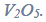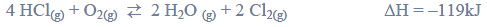W przemyśle wodór można otrzymać w procesie konwersji metanu…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
W przemyśle wodór można otrzymać w procesie konwersji metanu będącego głównym
składnikiem gazu ziemnego. W mieszaninie gazu ziemnego i pary wodnej w pewnej
temperaturze T i w obecności katalizatora niklowego zachodzą m.in. reakcje opisane
poniższymi równaniami.
I CH4 (g) + H2O (g) ⇄ CO (g) + 3H2 (g)
II CH4 (g) + 2H2O (g) ⇄ CO2 (g) + 4H2 (g)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa, 1994.
Jedną z opisanych reakcji przedstawia poniższy schemat
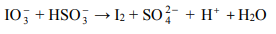
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie procesu redukcji:
Równanie procesu utleniania:
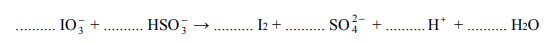
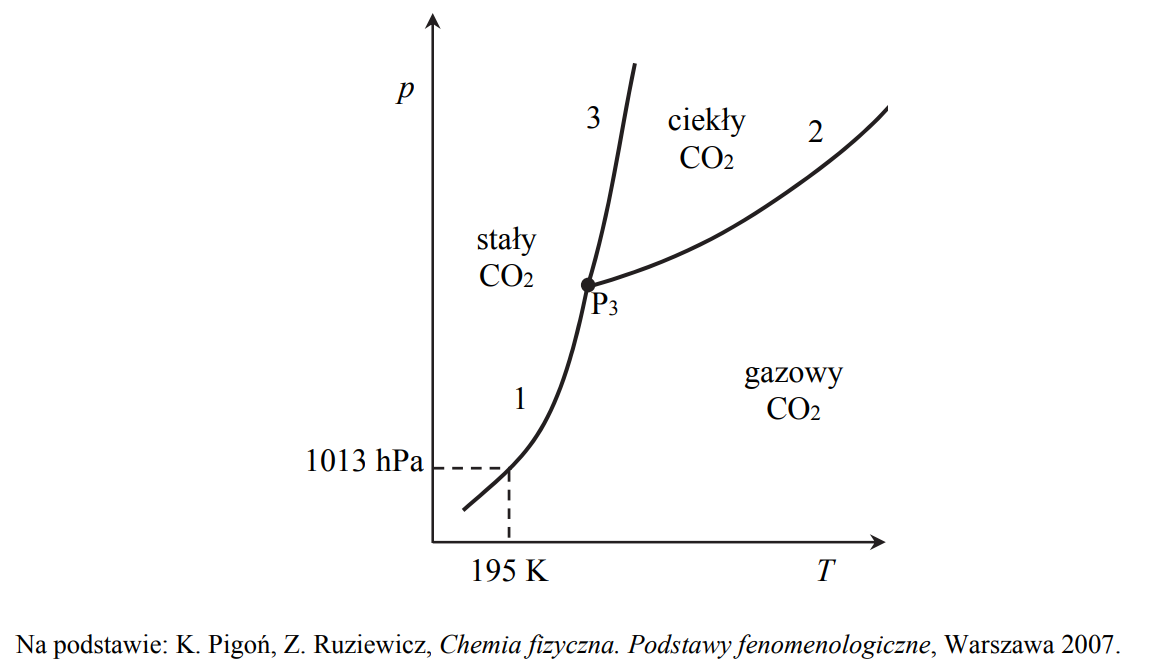
Diagram fazowy tlenku węgla(IV).
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Poniższy diagram fazowy tlenku węgla(IV) przedstawia wartości temperatury i ciśnienia, w których CO2 występuje w różnych fazach: w stanie stałym, ciekłym lub gazowym. Linie ciągłe określają warunki temperatury i ciśnienia, w których istnieje trwała równowaga między
dwiema fazami. W punkcie oznaczonym symbolem P3 (T = 216 K i p = 5100 hPa) CO2 występuje w trzech fazach znajdujących się w stanie równowagi.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

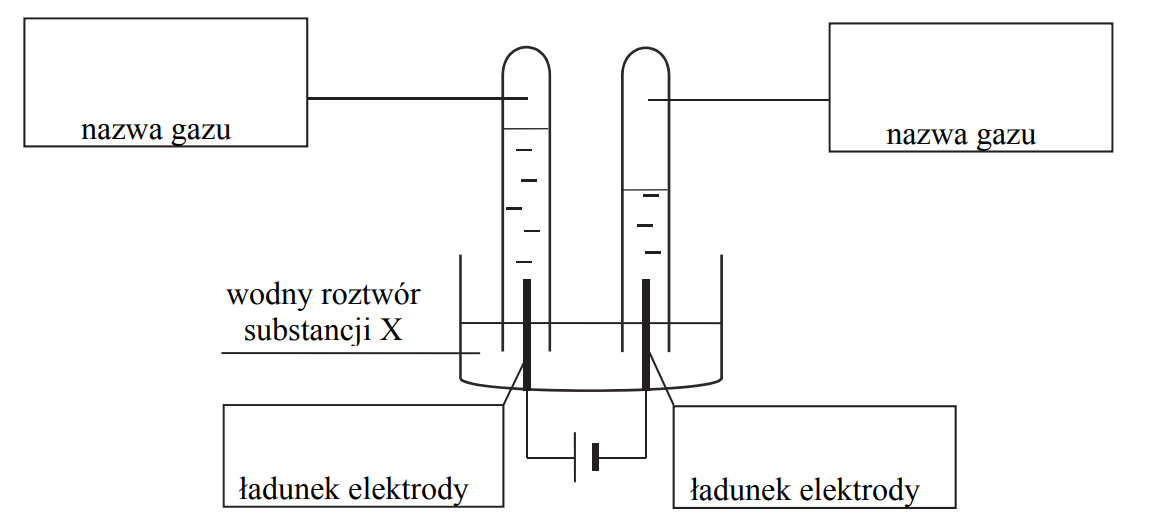
Elektroliza roztworu chlorowodoru.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Elektroliza wodnego roztworu HCl przebiega zgodnie z równaniem:
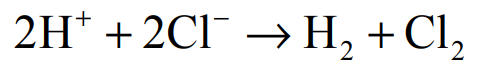
Podczas elektrolizy przez wodny roztwór HCl o objętości 400,0 cm3
i o stężeniu 0,1 mol·dm−3 przepłynął ładunek 3821,4 C.
Wykonaj odpowiednie obliczenia i określ, jak się zmieniło (wzrosło czy zmalało), i o ile jednostek, pH tego roztworu w wyniku elektrolizy. Podczas rozwiązywania zadania nie zaokrąglaj wyników pośrednich. Stała Faradaya ma wartość F = 96500 C · mol–1. Przyjmij, że objętość roztworu nie uległa zmianie, a podczas elektrolizy nie zachodziły procesy uboczne, np. rozkład wody.