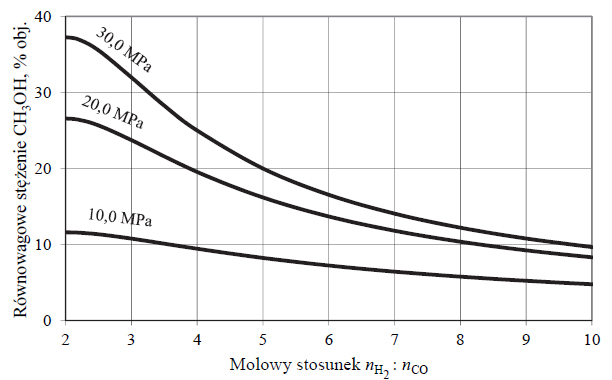
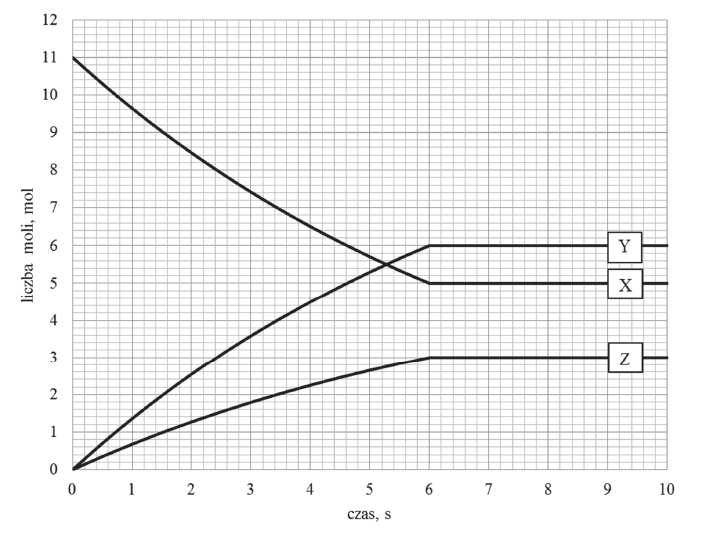
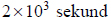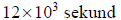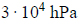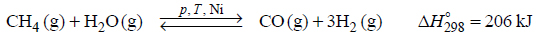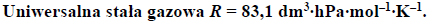Elektroliza wodnego roztworu siarczanu (VI) potasu
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Przez 161 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) potasu prądem stałym o natężeniu 1,49 ampera. Zastosowano elektrody platynowe. Stwierdzono, że podczas elektrolizy zaszły procesy elektrodowe rozkładu wody.
1. Napisz równanie procesu zachodzącego podczas elektrolizy tej soli na katodzie oraz równanie procesu przebiegającego podczas elektrolizy tej soli na anodzie.
2. Oblicz, ile gramów gazowego produktu wydzieliło się na katodzie podczas tego procesu, jeżeli przebiegał on ze 100% wydajnością prądową.