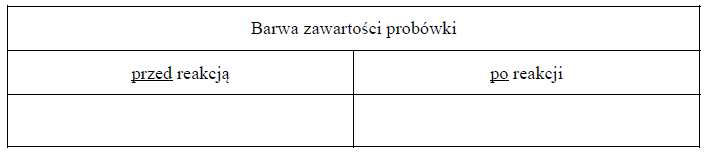
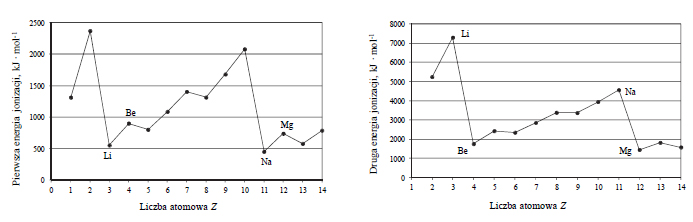
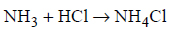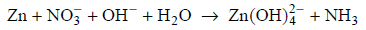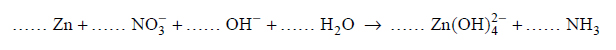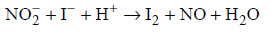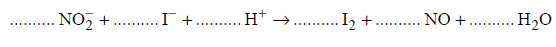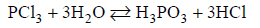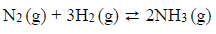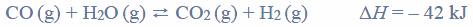Reakcje redukcji tlenku azotu wodorem.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
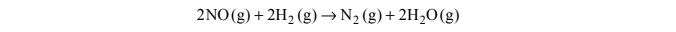
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:
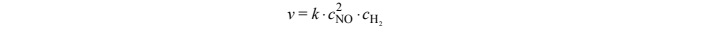
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, c NO i H2 c oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna. Podstawy fenomenologiczne, Warszawa 2007.
W zamkniętym reaktorze o pojemności 2 dm3
zmieszano 6 moli tlenku azotu(II) i 4 mole
wodoru. Podczas reakcji utrzymywano stałą temperaturę.

Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
Reakcję syntezy tlenku azotu(II).
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Reakcję syntezy tlenku azotu(II) ilustruje równanie:
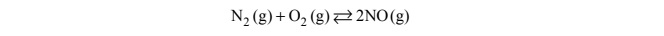
W tabeli podano wartości stężeniowej stałej równowagi Kc reakcji syntezy NO w różnych
temperaturach.
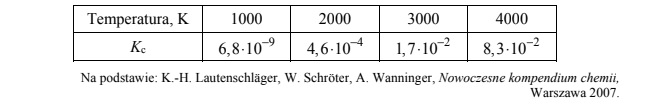
Oceń, czy opisana reakcja jest procesem egzo- czy endotermicznym, oraz spośród poniższych sposobów prowadzenia reakcji wybierz ten powodujący zwiększenie wydajności tworzenia tlenku azotu(II).

Opisana reakcja jest procesem
Numer sposobu zwiększenia wydajności tworzenia tlenku azotu(II):
Wpływ ciśnienia i temperatury w warunkach izotemricznych i izobarycznych.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Na poniższym wykresie zilustrowano zmianę energii potencjalnej podczas reakcji opisanej
równaniem
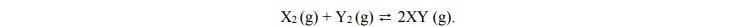
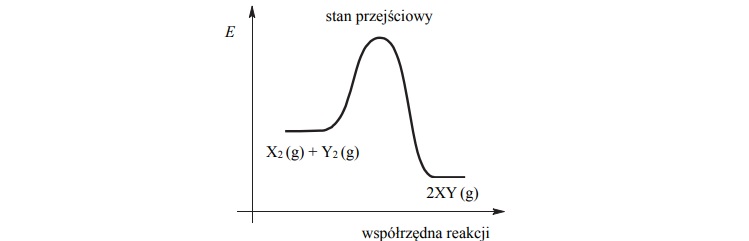
Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie wydajność
reakcji otrzymywania produktu XY, jeżeli w układzie będącym w stanie równowagi
nastąpi
• wzrost temperatury w warunkach izobarycznych (p = const)
• wzrost ciśnienia w warunkach izotermicznych (T = const).
Schemat ogniwa galwaicznego. Obliczanie SEM.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Zbudowano ogniwo według schematu przedstawionego na poniższym rysunku.
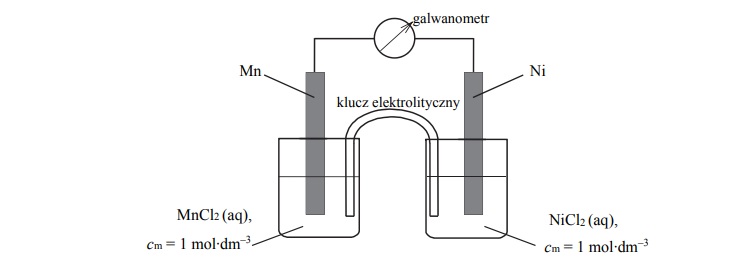
Oblicz siłę elektromotoryczną (SEM), w warunkach standardowych, ogniwa, którego
schemat przedstawiono na rysunku.
SEM =

Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w czasie
pracy tego ogniwa.
Reakcja tlenku żelaza (III) z tlenkiem węgla (II)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
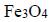
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.
Przemysłowa produkcja żelaza. Tlenek żelaza (II, III)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
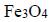
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.