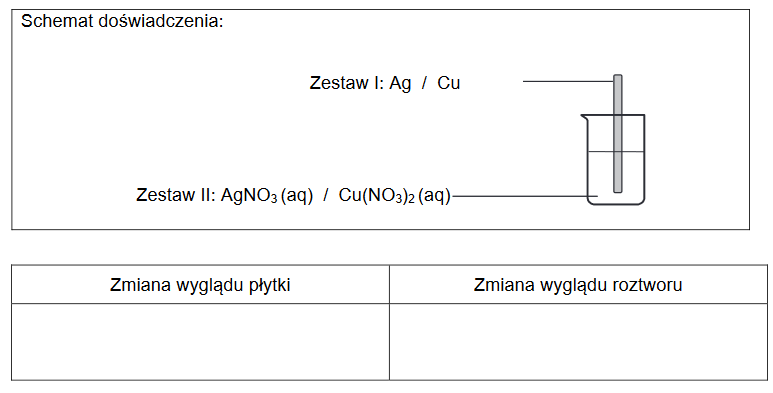
porównanie aktywności chemicznej metali
Arkusz z chemii rozszerzonej czerwiec 2021
Przeprowadzono doświadczenie zgodnie z poniższym schematem.
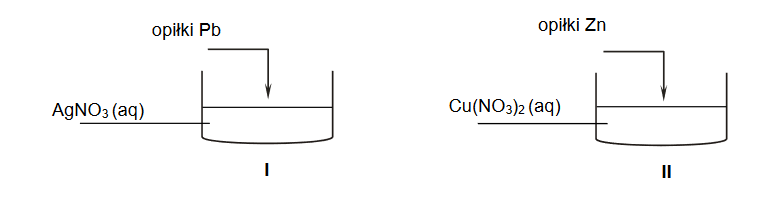
1. Napisz w formie jonowej skróconej równanie reakcji zachodzącej po dodaniu opiłków ołowiu do zlewki I. Rozstrzygnij, czy po zakończeniu doświadczenia masa roztworu w zlewce I wzrosła czy zmalała. Odpowiedź uzasadnij.
Równanie zachodzącej reakcji:
Rozstrzygnięcie:
Uzasadnienie:
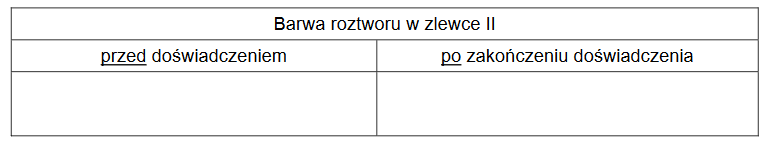
2. Po zakończeniu doświadczenia na dnie zlewki II znajdowały się dwa metale: cynk oraz miedź. Uzupełnij poniższą tabelę. Napisz, jaką barwę miał roztwór w probówce II przed reakcją i po jej zakończeniu.
reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
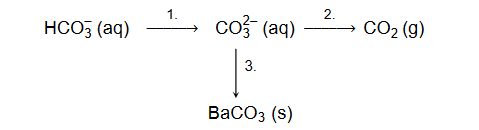
1. Spośród wymienionych odczynników
● wodorotlenek potasu
● kwas etanowy
● siarczan(VI) baru
● azotan(V) baru
wybierz i wpisz do tabeli nazwy lub wzory tych substancji, które mogły być użyte w poszczególnych etapach opisanego schematem ciągu przemian.
2. Napisz w formie jonowej skróconej równania reakcji oznaczonych na schemacie numerami 1. i 2.
Równanie reakcji 1.:
Równanie reakcji 2.:
planowanie i opisywanie doświadczeń
Arkusz z chemii rozszerzonej maj 2021
W dwóch probówkach znajdowały się wodne roztwory soli X i Z, otrzymane przez rozpuszczenie stałych soli, z których jedną był siarczek potasu, a drugą – bromek potasu. Przeprowadzono doświadczenie zgodnie z poniższym schematem. W doświadczeniu użyto świeżo otrzymanej wody chlorowej.
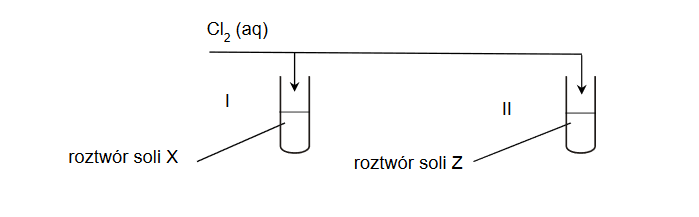
Po dodaniu wody chlorowej do probówek zauważono, że w probówce I roztwór zmienił barwę,
ale pozostał klarowny, natomiast w probówce II pojawiło się zmętnienie.
1. Zidentyfikuj sole X i Z i wpisz ich wzory do tabeli.
2. Napisz w formie jonowej skróconej równania reakcji pomiędzy chlorem a bromkiem potasu oraz pomiędzy chlorem a siarczkiem potasu.
właściwości chemiczne metali wobec rozcieńczonych i stężonych roztworów kwasów
Arkusz z chemii rozszerzonej maj 2021
W dwóch nieoznaczonych probówkach znajdowały się oddzielnie: rozcieńczony wodny roztwór kwasu azotowego(V) i rozcieńczony wodny roztwór kwasu siarkowego(VI). W tych roztworach zanurzono blaszki miedziane, a zawartość probówek lekko ogrzano.
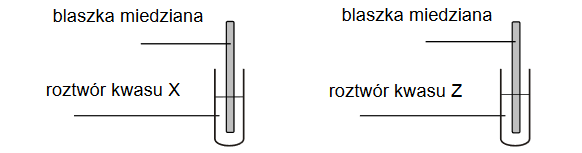
Po zanurzeniu blaszki miedzianej w roztworze kwasu X i ogrzaniu zawartości probówki wydzielał się bezbarwny gaz, który w kontakcie z powietrzem zabarwiał się na kolor czerwonobrunatny.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
W rozcieńczonym roztworze kwasu azotowego(V) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje) i roztwór (przyjmuje barwę
niebieską / pozostaje bezbarwny). W rozcieńczonym roztworze kwasu siarkowego(VI) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje)
i roztwór (przyjmuje barwę niebieską / pozostaje bezbarwny). Kwasem X jest (HNO3 / H2 SO4).
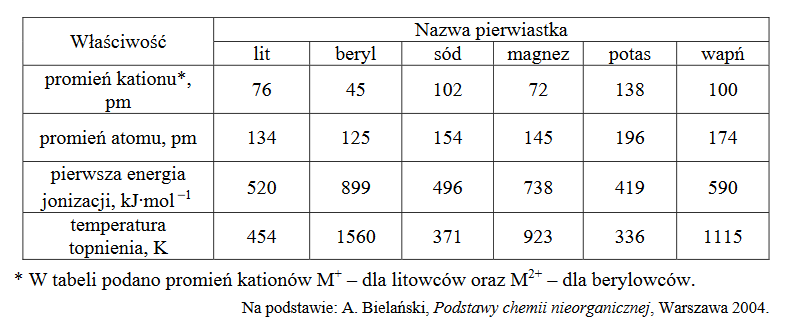
analiza i porównanie właściwości chemicznych metali
Arkusz z chemii rozszerzonej marzec 2021
Do dwóch zlewek zawierających jednakowe objętości wody o temperaturze t = 20 °C dodano:
• do zlewki I – próbkę metalicznego magnezu
• do zlewki II – próbkę metalicznego wapnia.
Tylko w jednej zlewce zaobserwowano objawy reakcji chemicznej.
Napisz w formie jonowej równanie reakcji zachodzącej podczas opisanego doświadczenia. Wyjaśnij przyczynę różnej aktywności chemicznej badanych metali.
Równanie reakcji:
Wyjaśnienie:
charakter chemiczny wodorotlenku glinu
Arkusz z chemii rozszerzonej marzec 2021
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
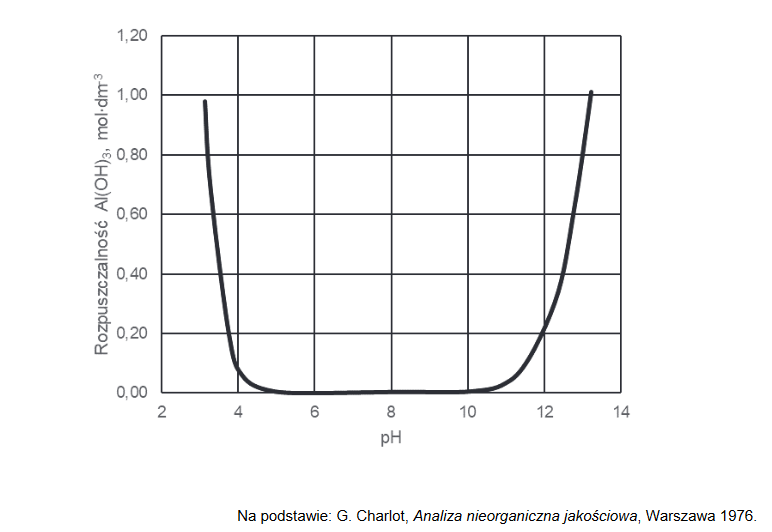
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu.
Charakter chemiczny:
Równania reakcji:
Struktura atomu – jądro i elektrony
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Atomy pewnego pierwiastka oznaczonego umownie symbolem X mają w stanie podstawowym następującą konfigurację elektronową:
1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁵
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

elektroujemność w skali Paulinga
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Na poniższym diagramie przedstawiono zmiany elektroujemności w skali Paulinga pierwiastków grup 1.–2. oraz 13.–17. układu okresowego (wartości elektroujemności poszczególnych pierwiastków danej grupy połączono linią ciągłą).
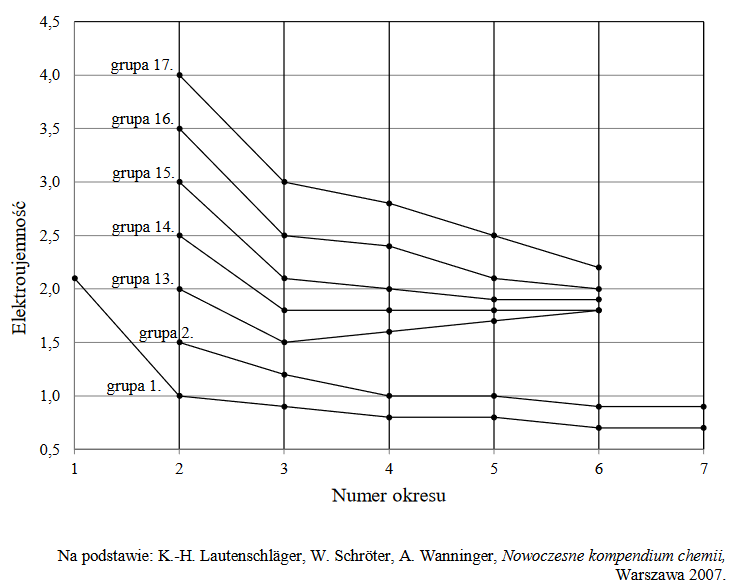
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

właściwości fizyczne i chemiczne glinu
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Na odważkę stopu glinu z magnezem o masie 7,50 g podziałano nadmiarem rozcieńczonego kwasu solnego. Podczas roztwarzania stopu w kwasie solnym zachodziły reakcje zilustrowane równaniami:
2Al + 6HCl → 2AlCl₃ + 3H₂
Mg + 2HCl → MgCl₂ + H₂
W wyniku całkowitego roztworzenia stopu otrzymano klarowny roztwór, do którego dodano nadmiar wodnego roztworu wodorotlenku sodu. Zaszły reakcje opisane równaniami:
AlCl₃ + 6NaOH → Na₃[Al(OH)₆] + 3NaCl
MgCl₂ + 2NaOH → Mg(OH)₂ + 2NaCl
Otrzymany nierozpuszczalny w wodzie związek odsączono, przemyto wodą, wysuszono i zważono. Jego masa (w przeliczeniu na czysty wodorotlenek magnezu) była równa 11,67 g.
1. Oblicz zawartość procentową glinu w stopie (w procentach masowych).
2. Klarowny roztwór uzyskany po odsączeniu osadu Mg(OH)2 nasycono tlenkiem węgla(IV).
Zaobserwowano wytrącenie białego osadu wodorotlenku glinu.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej.