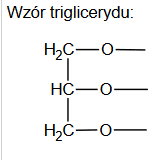
gęstości wody bromowej i chloroformu
Arkusz diagnostyczny z chemii 2022 grudzień
Na zdjęciu obok pokazano dwuetapowe doświadczenie, podczas którego do probówki wprowadzono kilka cm³ chloroformu (CHCl₃) oraz wodę bromową (etap 1.), a następnie ciecze wymieszano i pozostawiono na pewien czas (etap 2.).

Przedstaw wniosek z pokazanego doświadczenia dotyczący porównania gęstości wody bromowej i chloroformu. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy.
Gęstość chloroformu jest ? niż gęstość wody bromowej.
Nazwa procesu:
aflatoksyna B1 – silnie toksyczny, rakotwórczy związek wytwarzany przez pleśnie
Arkusz diagnostyczny z chemii 2022 grudzień
Jednym z silnie toksycznych związków wytwarzanych przez pleśnie jest aflatoksyna B1, wykazująca właściwości rakotwórcze. Poniższy wzór przedstawia strukturę cząsteczki tego związku.
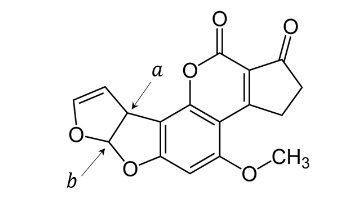
Uzupełnij tabelę. Wpisz formalne stopnie utlenienia atomów węgla oznaczonych literami 𝒂 i 𝒃 we wzorze cząsteczki aflatoksyny B1 oraz określ typ hybrydyzacji, jaki można przypisać orbitalom walencyjnym atomu węgla 𝒂.

Budowa atomu – promienie atomowe
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
W poniższej tabeli podano wartości promieni atomowych r1, r2, r3 i r4 atomów czterech pierwiastków.
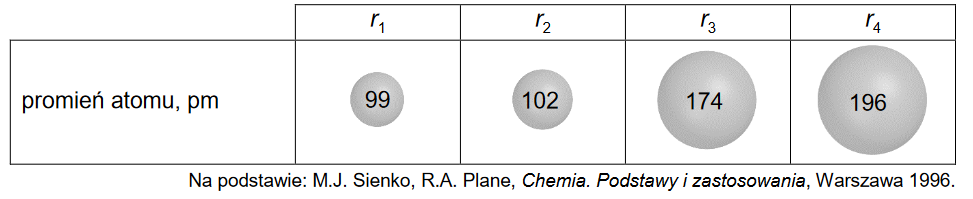
Uzupełnij poniższą tabelę. Na podstawie zmienności promieni atomów w grupach i okresach przyporządkuj wymienionym pierwiastkom wartości promieni atomowych ich atomów.
obliczenia w reaktorze
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Do reaktora o pojemności 1,0 dm3 wprowadzono pewną liczbę moli substancji A oraz pewną liczbę moli substancji B. Reaktor zamknięto i zainicjowano reakcję chemiczną, która przebiegała w stałej temperaturze T zgodnie z równaniem:
A (g) + B (g) ⇄ C (g) + D (g)
Do momentu ustalenia stanu równowagi przereagowało 20 % substancji A. W tych warunkach stężeniowa stała równowagi opisanej reakcji jest równa 2,0.
Oblicz, jaki procent liczby moli wyjściowej mieszaniny stanowiła substancja A.
Nadtlenek sodu i jego reakcje
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Produktem spalania metalicznego sodu w tlenie jest nadtlenek sodu o wzorze Na2O2. W wyniku reakcji tego związku z sodem w podwyższonej temperaturze można otrzymać tlenek sodu Na2O. Każdy z opisanych związków sodu z tlenem ma budowę jonową i tworzy sieć krystaliczną zbudowaną z kationów i anionów.
Nadtlenek sodu reaguje gwałtownie z wodą. Jednym z produktów tej reakcji, zachodzącej bez zmiany stopni utlenienia, jest nadtlenek wodoru H2O2.
1. Napisz wzór anionu występującego w nadtlenku sodu oraz wzór anionu występującego w tlenku sodu.
Wzór anionu w nadtlenku sodu:
Wzór anionu w tlenku sodu:
2. Napisz w formie cząsteczkowej równanie reakcji nadtlenku sodu z wodą.
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Oblicz, ile gramów soli uwodnionej Na2SO4 10H2O należy dodać do 100 g roztworu, w którym stężenie Na2SO4 wynosi 6,0 % masowych, aby – po uzupełnieniu wodą do 300 g – otrzymać roztwór tej soli o stężeniu 10 %. W obliczeniach przyjmij, że masy molowe soli są równe:
M Na2SO4 = 142 g ∙ mol–1 oraz
M Na2SO4 ∙10H2O = 322 g ∙ mol–1 .
Roztwory i reakcje zachodzące w roztworach wodnych
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Przygotowano roztwór bromu w dichlorometanie (rozpuszczalniku organicznym o wzorze CH2Cl2) o stężeniu 2,0 % masowych. Przez płuczkę zawierającą 280 gramów opisanego roztworu bromu przepuszczano bez dostępu światła mieszaninę etanu, etenu i etynu.
Podczas doświadczenia przebiegły wyłącznie reakcje zilustrowane poniższymi równaniami:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
Do momentu całkowitego odbarwienia roztworu bromu przez płuczkę przepuszczono 521 cm3 mieszaniny gazów (objętość gazów podano w przeliczeniu na warunki normalne). Ustalono także, że po przejściu przez płuczkę objętość mieszaniny gazów była mniejsza o 86 %.
Oblicz wyrażoną w procentach objętościowych zawartość etynu w mieszaninie zawierającej etan, eten i etyn.
konfiguracja elektronowa atomów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Poniżej przedstawiono konfigurację elektronową atomów czterech pierwiastków (I – IV):
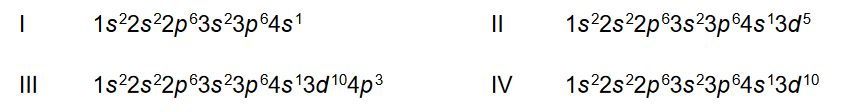
Napisz, która z przedstawianych konfiguracji elektronowych opisuje atom w stanie wzbudzonym. Odpowiedź uzasadnij.
Konfiguracja:
Uzasadnienie:
otrzymywanie izotopu tenesu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
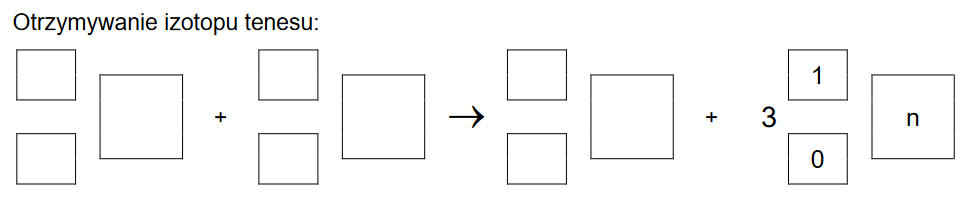
Tenes – pierwiastek chemiczny o liczbie atomowej Z = 117 – otrzymano w reakcji jądrowej między 48Ca i 249Bk. W tym procesie powstały dwa izotopy tenesu, przy czym reakcji tworzenia jądra jednego z tych izotopów towarzyszyła emisja 3 neutronów. Ten izotop ulegał dalszym przemianom: w wyniku kilku kolejnych przemian α otrzymano dubn – 270Db.
Napisz równanie reakcji otrzymywania opisanego izotopu tenesu – uzupełnij wszystkie pola w poniższym schemacie. Napisz, w wyniku ilu przemian 𝛂 ten izotop tenesu przekształcił się w 270Db.
Otrzymywanie izotopu tenesu:
Liczba przemian α: