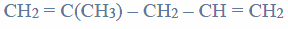Pierwiastek X tworzy aniony proste…
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Elektrony walencyjne w atomach (w stanie podstawowym) pewnego pierwiastka, którego symbol oznaczono umownie literą X, mają następującą konfigurację:
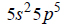
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Określanie położenia w układzie okresowym na podstawie elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
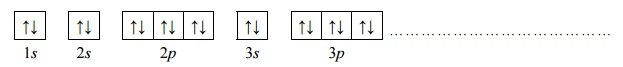
Konfiguracja elektronów uczestniczących w tworzeniu wiązań atomu pierwiastka Z jest następująca:
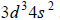
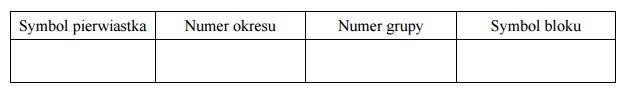
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka Z, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy ten pierwiastek.
Tworzenie wiązań wodorowych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
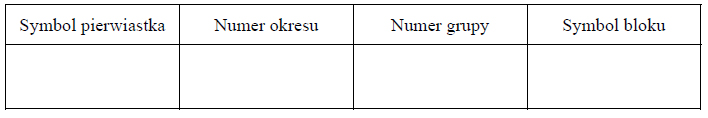
Spośród substancji, których wzory przedstawiono poniżej, wybierz wszystkie, w których między cząsteczkami danej substancji mogą się tworzyć wiązania wodorowe. Wybrane wzory podkreśl.
Udział wiązania jonowego w charakterze całego wiązania.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Miarą polaryzacji wiązania jest udział jonowego charakteru w tym wiązaniu: procentowy udział jonowego charakteru w wiązaniu =
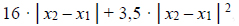
gdzie x1 i x2 oznaczają elektroujemności pierwiastków tworzących wiązanie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W tabeli zapisano informacje dotyczące wiązania jonowego.
Rozstrzygnij, która z nich jest prawdziwa. Zaznacz P przy zdaniu prawdziwym.

Reakcja amoniaku z chlorowodorem.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Gazowy amoniak reaguje z gazowym chlorowodorem zgodnie z równaniem
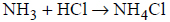
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie.
Produkt reakcji amoniaku i chlorowodoru występuje w warunkach normalnych w (stałym / ciekłym / gazowym) stanie skupienia. Kation amonowy NH4+ powstaje w wyniku
(przyłączenia protonu / oddania protonu) przez cząsteczkę amoniaku. W tym kationie (wszystkie / nie wszystkie) atomy wodoru są równocenne. W reakcji z chlorowodorem amoniak pełni funkcję (kwasu / zasady) Brønsteda.
Hybrydyzacja i budowa przestrzenna metanu, amoniaku i wody.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
W cząsteczkach
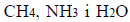
występuje ten sam typ hybrydyzacji orbitali walencyjnych atomu centralnego, ale w każdej z tych cząsteczek wartość kąta pomiędzy wiązaniami jest inna. Wynosi ona około 109° w cząsteczce CH4, około 107° w cząsteczce NH3 i około 105° w cząsteczce H2O.
Określ typ hybrydyzacji (sp, sp2 , sp3 ) orbitali walencyjnych atomu centralnego w cząsteczkach CH4, NH3 i H2O oraz napisz, co jest przyczyną różnicy wartości kąta pomiędzy wiązaniami w tych cząsteczkach.
Rozpoznawanie pierwiastka na podstawie konfiguracji elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Dwa pierwiastki umownie oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz ten pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
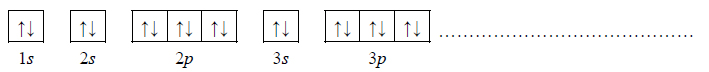
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.
Wykrywanie wiązania jonowego w cząsteczkach.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Spośród substancji, których wzory podano poniżej, wybierz wszystkie związki jonowe. Podkreśl wzory wybranych substancji.
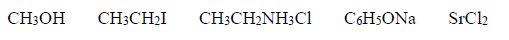
Kształt chloroformu (trichlorometanu) oraz wzór elektronowy.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Chloroform (trichlorometan) o wzorze CHCl3 i trichlorek fosforu o wzorze PCl3 są związkami kowalencyjnymi.
1. Określ kształt cząsteczki chloroformu (cząsteczka tetraedryczna, płaska, liniowa).
2. Narysuj wzór elektronowy cząsteczki CHCl3 oraz wzór elektronowy cząsteczki PCl3 – zaznacz kreskami wiązania chemiczne oraz wolne pary elektronowe.
3. Oceń, czy atom centralny w cząsteczce chloroformu i w cząsteczce trichlorku fosforu może tworzyć wiązanie koordynacyjne. Odpowiedź uzasadnij.
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
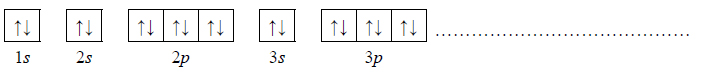
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.
Budowa chlorku arsenu (III), reakcja z wodą.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Chlorek arsenu(III) – AsCl3 – jest w temperaturze pokojowej cieczą. W stanie ciekłym chlorek arsenu(III) nie przewodzi prądu elektrycznego. W reakcji z wodą tworzy kwas arsenowy(III) o wzorze H3AsO3 oraz chlorowodór.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
1. Czy chlorek arsenu(III) ma budowę kowalencyjną, czy – jonową? Narysuj wzór elektronowy chlorku arsenu(III). Uwzględnij wolne pary elektronowe.
2. Napisz w formie cząsteczkowej równanie reakcji chlorku arsenu(III) z wodą.