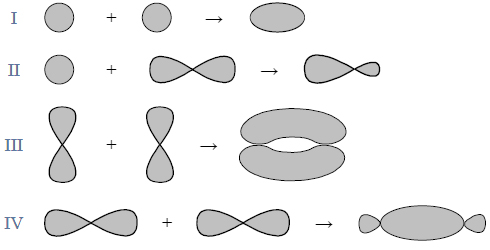
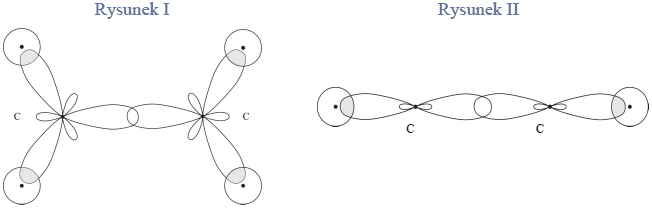
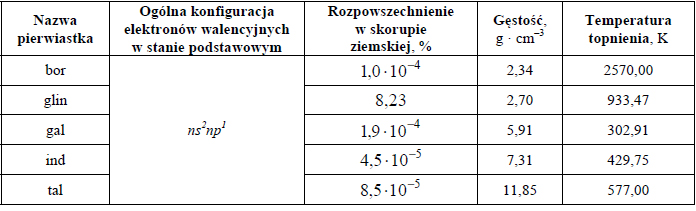
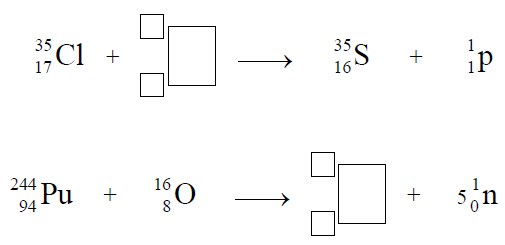
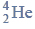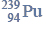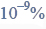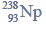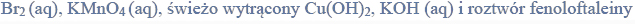Budowa i wiązania arsenowodoru.
Zbiór zadań maturalnych z chemii CKE 2015
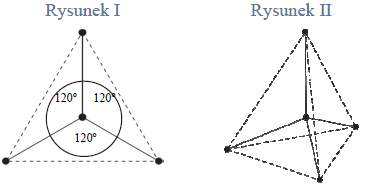
Cząsteczka arsenowodoru
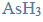
ma kształt piramidy o podstawie trójkąta równobocznego, w którego narożach znajdują się środki atomów wodoru.
Napisz wzór elektronowy cząsteczki arsenowodoru, zaznaczając kreskami wiązania chemiczne i wolne pary elektronowe. Określ typ hybrydyzacji atomu arsenu w cząsteczce tego związku chemicznego.
Budowa witaminy A, retinolu.
Zbiór zadań maturalnych z chemii CKE 2015
Witamina A to zbiorcza nazwa organicznych związków chemicznych z grupy retinoidów pełniących w organizmie funkcję niezbędnego składnika pokarmowego. Podstawową formą, w jakiej występuje witamina A, jest retinol, czyli cząsteczka o następującym wzorze:
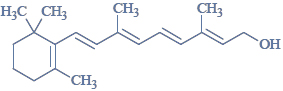
Podaj liczbę atomów węgla o typie hybrydyzacji sp2 występujących w cząsteczce retinolu.
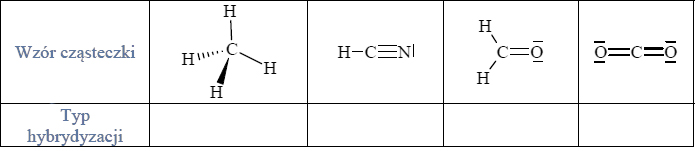
Hybrydyzacja atomu węgla w cząsteczkach.
Informator maturalny z chemii CKE 2015
Określ typ hybrydyzacji orbitali atomu węgla w cząsteczkach związków, których wzory podano poniżej. Uzupełnij tabelę.
Typ hybrydyzacji atomu azotu w cząsteczce amoniaku.
Informator maturalny z chemii CKE 2015
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.