identyfikacja związków chemicznych rozpuszczalnych w wodzie
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Poniżej podano wzory pięciu rozpuszczalnych w wodzie związków chemicznych.
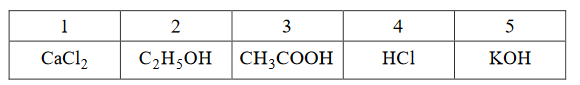
Wypełnij tabelę – wpisz numery, którymi oznaczono wzory wszystkich związków wykazujących podane w tabeli właściwości.

właściwości fizyczne i chemiczne glinu
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Na odważkę stopu glinu z magnezem o masie 7,50 g podziałano nadmiarem rozcieńczonego kwasu solnego. Podczas roztwarzania stopu w kwasie solnym zachodziły reakcje zilustrowane równaniami:
2Al + 6HCl → 2AlCl₃ + 3H₂
Mg + 2HCl → MgCl₂ + H₂
W wyniku całkowitego roztworzenia stopu otrzymano klarowny roztwór, do którego dodano nadmiar wodnego roztworu wodorotlenku sodu. Zaszły reakcje opisane równaniami:
AlCl₃ + 6NaOH → Na₃[Al(OH)₆] + 3NaCl
MgCl₂ + 2NaOH → Mg(OH)₂ + 2NaCl
Otrzymany nierozpuszczalny w wodzie związek odsączono, przemyto wodą, wysuszono i zważono. Jego masa (w przeliczeniu na czysty wodorotlenek magnezu) była równa 11,67 g.
1. Oblicz zawartość procentową glinu w stopie (w procentach masowych).
2. Klarowny roztwór uzyskany po odsączeniu osadu Mg(OH)2 nasycono tlenkiem węgla(IV).
Zaobserwowano wytrącenie białego osadu wodorotlenku glinu.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej.
obliczenia z uwzględnieniem wydajności reakcji
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Przeprowadzono doświadczenie, w którym do czterech ponumerowanych zlewek I–IV zawierających po 100cm³ wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol dm⁻³ dodano wodne roztwory różnych substancji i wodę destylowaną zgodnie z poniższym rysunkiem.
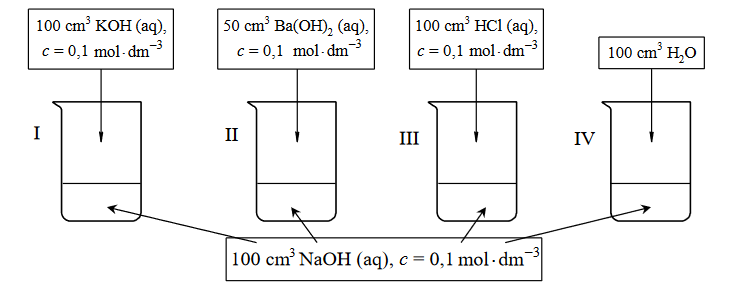
Uzupełnij poniższą tabelę – podaj wartość pH wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol ∙ dm⁻³ oraz wpisz numery zlewek, w których pH otrzymanego roztworu było niższe albo było wyższe od pH roztworu wyjściowego, albo nie uległo zmianie w czasie doświadczenia.

interpretacja jakościowa i ilościowa równania reakcji w ujęciu molowym
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Podczas spalania 0,25 mola pewnego węglowodoru przebiegła reakcja chemiczna zilustrowana ogólnym równaniem:
CnH2n + 1,5nO₂ → nCO₂ + nH₂O
W wyniku opisanej przemiany otrzymano 46,5 g mieszaniny tlenku węgla(IV) i pary wodnej.
Wykonaj obliczenia i zaproponuj wzór półstrukturalny (grupowy) spalanego węglowodoru.
typy hybrydyzacji w prostych cząsteczkach związków
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
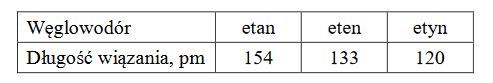
W poniższej tabeli zestawiono długości wiązania między atomami węgla w cząsteczkach etanu, etenu i etynu.
Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
W cząsteczce etanu przyjmuje się dla orbitali walencyjnych atomów węgla hybrydyzację typu (sp / sp2 / sp3). Kąt między wiązaniami wytworzonymi przez każdy atom węgla w cząsteczce etenu jest bliski (109º / 120º / 180º), a w cząsteczce etynu ten kąt jest równy (109º / 120º / 180º). Wiązanie węgiel – węgiel jest tym krótsze, im (mniejsza / większa) jest jego krotność.
obliczenia związane z przygotowaniem roztworów
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Kwas etanodiowy o wzorze (COOH)2 jest najprostszym kwasem dikarboksylowym, którego rozpuszczalność w wodzie w temperaturze 20 ºC jest równa 9,52 g bezwodnego kwasu w 100 g wody.
Oblicz minimalną masę wody potrzebną do rozpuszczenia 14,0 gramów hydratu kwasu etanodiowego o wzorze (COOH)₂ · 2H₂O w temperaturze 20 ºC. Wynik końcowy podaj w gramach i zaokrąglij do jedności.
kwasy i zasady – klasyfikacja zgodna z teorią Brønsteda–Lowry`ego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Jon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
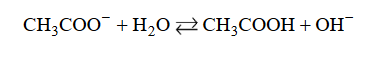
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:
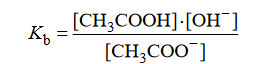
Iloczyn stałej dysocjacji kwasowej Ka kwasu CH₃COOH i stałej dysocjacji zasadowej Kb sprzężonej z nim zasady CH3COO⁻ jest równy iloczynowi jonowemu wody: Ka∙Kb = Kw. W temperaturze 25ºC iloczyn jonowy wody jest równy Kw = 1, 0 * 10⁻¹⁴.
Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 mol*dm⁻³ w temperaturze 25 ºC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych
Pierwiastki X i Z leżą w czwartym okresie układu okresowego.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem, natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek Z występuje w postaci dwuatomowych cząsteczek.
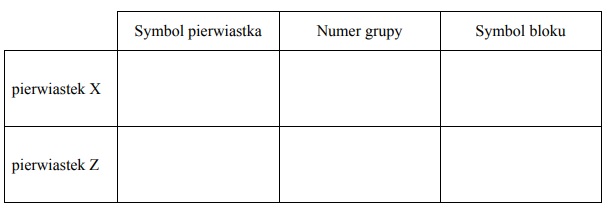
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
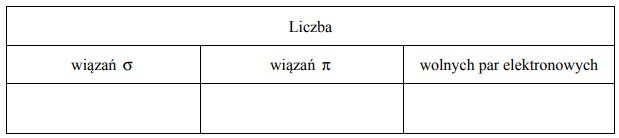
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Oblicz masę mx drugiego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz masę atomową mx drugiego izotopu galu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.

Oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu, który ma mniejszą masę atomową.

Przemiany izotopu uranu 235 i jego rozpad.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Radioaktywny izotop uranu 235 U w trakcie naturalnego rozpadu promieniotwórczego ulega przemianie α, dalej następuje przemiana β − i ponownie α.
Podaj symbol pierwiastka i liczbę masową izotopu, który powstał w wyniku tych trzech przemian jądrowych.
Połowiczny rozpad próbki chlorku sodu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Próbka chlorku sodu zawierała 0,25 milimola promieniotwórczego nuklidu
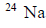
W czasie 30 godzin rozpadowi uległo 75 % tego nuklidu.
1. Oblicz masę sodu 24Na, który uległ w tym czasie rozpadowi. Przyjmij, że masa atomowa tego nuklidu jest równa jego liczbie masowej.
2. Określ okres półtrwania (τ1/2) tego izotopu.
Przemiany promieniotwórcze izotopu radu 226
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Izotop radu 226Ra ulega rozpadowi α. Tej przemianie towarzyszy emisja promieniowania γ. Cząstki α emitowane przez rad mogą służyć do wybijania neutronów z lekkich jąder, np. berylu 9Be.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Napisz równania opisanych przemian jądrowych. Uzupełnij wszystkie pola w poniższych schematach.
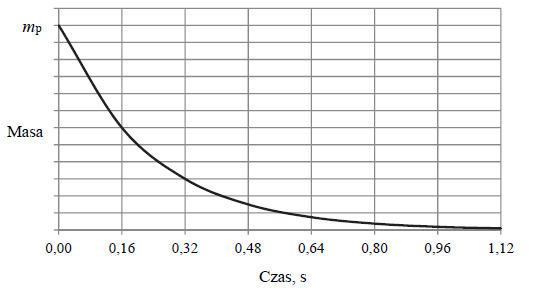
Rozkład promieniotwórczy izotopu polonu 216
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Poniżej przedstawiono wykres zależności masy promieniotwórczego izotopu polonu 216Po od czasu. Symbol mp oznacza początkową masę izotopu.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Odczytaj z wykresu wartość okresu półtrwania izotopu polonu 216Po . Określ, po ilu sekundach w próbce zawierającej 100 mg izotopu polonu 216Po ulegnie rozpadowi 75 mg tego izotopu.